Una ilustración de la reacción química desarrollada en el estudio. Crédito:J. Waser / B. Fierz (EPFL)
Comprender la estructura y el metabolismo de las células y los organismos vivos es esencial para el desarrollo de nuevos fármacos y diagnósticos. La disponibilidad de herramientas químicas que permiten a los científicos editar biomoléculas, como proteínas, con resolución a nivel de átomo han contribuido en gran medida al progreso de la biología química.
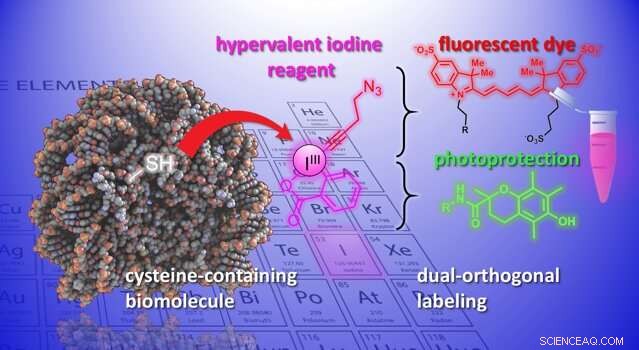
Las proteínas son macromoléculas construidas a partir de un conjunto de veinte aminoácidos químicamente diferentes. Un enfoque clave para modificar las proteínas es reaccionar con el átomo de azufre en el aminoácido cisteína. Sin embargo, Los métodos actuales siguen siendo problemáticos en términos de eficiencia. selectividad, y estabilidad del producto final (el "aducto").
Ahora, los laboratorios de Jérôme Waser y Beat Fierz en el Instituto de Ciencias Químicas e Ingeniería de EPFL han desarrollado un nuevo método para modificar cisteínas en péptidos y proteínas. El método utiliza un grupo de moléculas orgánicas altamente reactivas, las etinilbenziodoxolonas (EBX). Lo que hace que los EBX sean altamente reactivos es que contienen un átomo de yodo unido a tres grupos sustituyentes. Esta situación no natural conduce a una alta reactividad en estos reactivos denominados "yodo hipervalente".
Por primera vez, los investigadores pudieron generar un aducto simple de biomolécula-EBX mientras mantenían su grupo de yodo reactivo en la molécula final. La reacción puede ser realizada fácilmente por un no experto en condiciones fisiológicas estándar.
El producto final son quimeras reactivas de yodo hipervalente de proteínas que pueden actuar como puntos de unión duales para dos nuevos grupos químicos, abriendo nuevas oportunidades para el estudio de procesos biológicos.
"Se puede introducir una nueva funcionalidad a través de la 'química del clic, 'una reacción bien establecida en biología química, "dice Waser." Usando catalizadores de paladio, se puede lograr otra modificación selectiva en el átomo de yodo reactivo, lo que llamaríamos una funcionalidad 'biortogonal', ya que no existe en la naturaleza ". La introducción de grupos reactivos tan exóticos en biomoléculas es actualmente una de las herramientas más importantes de la biología química, ya que permite el estudio de procesos biológicos sin interferir con ellos.
Los científicos demostraron el potencial del método al introducir un conjunto diverso de grupos químicos en biomoléculas. Por ejemplo, los científicos utilizaron el mango doble para unir un tinte fluorescente y un grupo fotoprotector en un neuropéptido simultáneamente. Combinarlos mejora la fotoestabilidad del tinte, y permite alta resolución, obtención de imágenes de una sola molécula de interacciones moleculares.
Más allá de los péptidos, modificaron aún más pequeñas proteínas, e incluso grandes complejos de proteína-ADN, los llamados nucleosomas. Como los nucleosomas organizan el genoma, etiquetarlos con tintes fluorescentes puede ayudar a rastrearlos para descifrar cómo la naturaleza regula la expresión genética.
"Lo que desarrollamos aquí es un nuevo método para modificar proteínas basado en estudios fundamentales de reactividad química, "dice Fierz." Ya lo hemos usado para modificar de histonas, y llevó a cabo experimentos de fluorescencia en células vivas. Con estos ejemplos, hemos sentado las bases para una mejor comprensión de los procesos biológicos ".
El estudio se publica en Chem hoy dia.