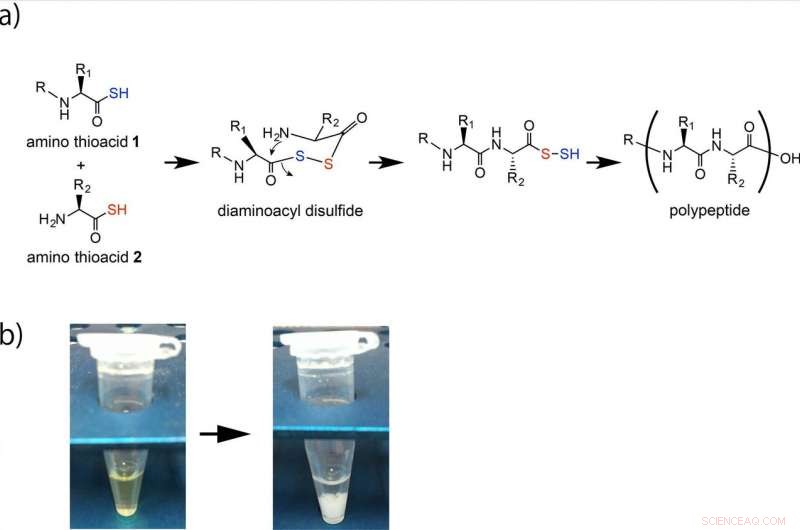
Formación de polipéptidos por reacción oxidativa de aminotioácidos. (a) Los amino tioácidos 1 y 2 se acoplan mediante un intermedio de disulfuro de diaminoacilo y la formación de amida intramolecular posterior genera un enlace alfa-amida. El mineral de hierro o Fe2O3 en solución ácida acelera la formación de este polipéptido. La ejecución repetitiva de esta reacción produce el polipéptido. (b) El polipéptido se forma como un precipitado blanco. Crédito:Universidad de Osaka
Los principales constituyentes de las células, tejido, órganos y los organismos completos son proteínas, que se construyen mediante la adición de aminoácidos uno tras otro para formar largas cadenas de proteínas llamadas polipéptidos. Aunque las células vivas tienen maquinaria avanzada que puede lograr esta extensión de cadena con asombrosa velocidad y precisión, Los esfuerzos para imitar esta reacción en el laboratorio con el fin de crear productos de péptidos naturales o fármacos peptídicos han seguido siendo toscos y laboriosos en comparación.
Usando variantes de aminoácidos llamados aminotioácidos, un equipo de la Universidad de Osaka ha superado estas dificultades para lograr la extensión precisa y simple de las cadenas de péptidos en una reacción rápida. Su trabajo, publicado en la revista Bioquímica , también sugiere que, hace miles de millones de años, Este mecanismo químico en particular podría haber permitido que aparecieran una gran cantidad de moléculas más grandes y complejas, proporcionando potencialmente las condiciones de las que eventualmente surgió la vida.
En este estudio, el equipo se centró en mejorar los esfuerzos anteriores para sintetizar polipéptidos artificialmente, en el que un gran obstáculo fue la necesidad de incluir grupos protectores. Dichos grupos protectores se agregan a los grupos funcionales dentro de una molécula para asegurar que una reacción posterior sea específica. Sin embargo, requieren que se realicen múltiples etapas de reacción, lo que hace que el procedimiento sea ineficaz.
"En nuestros esfuerzos por mejorar la formación de enlaces peptídicos artificiales, en lugar de centrarse en los aminoácidos, en cambio, miramos a los aminotioácidos, que incluyen un átomo de azufre, "Dice Yasuhiro Kajihara." Comenzamos con la versión aminotioácida de la fenilalanina como monómero, y bajo una reacción que duró solo cinco minutos, se encontró que se formaban cadenas de péptidos que contenían de dos a cinco fenilalaninas. Un análisis alternativo reveló cadenas de hasta 12 fenilalaninas ".
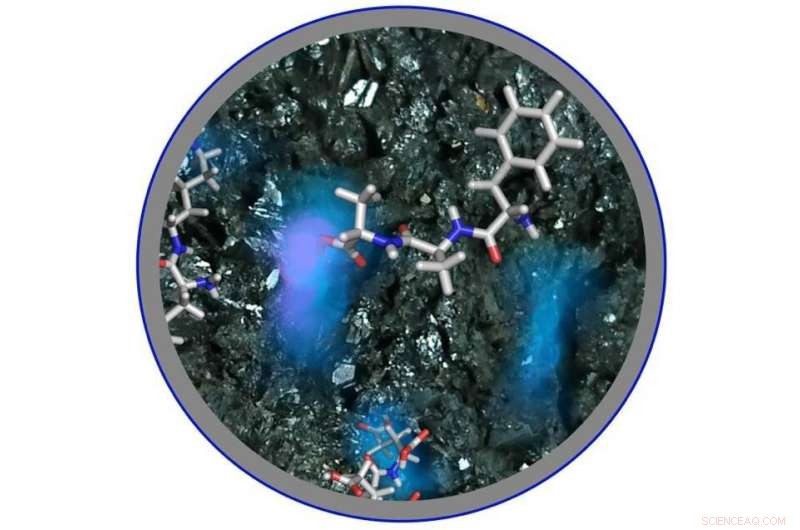
Una imagen de la formación de polipéptidos por los aminotioácidos en la superficie del mineral de hierro en una solución ácida. Crédito:Universidad de Osaka
Luego, el equipo demostró que la extensión de la cadena de péptidos se produjo con mezclas de aminotioácidos y también solo en condiciones ácidas. lo que sugirió que la oxidación era clave para el mecanismo involucrado. El equipo lo confirmó al caracterizar la reacción, y también demostró que se trataba de un intermedio de reacción único, lo que aseguró que el producto previsto se generara con precisión.
"Dado que la extensión de los aminoácidos regulares en cadenas es un factor clave para la vida, nos preguntamos si hace miles de millones de años, Los aminotioácidos podrían haber actuado como precursores de la química más compleja que condujo al desarrollo de la vida sensible. dada su rápida y sencilla incorporación a cadenas, ", dice el autor principal, Ryo Okamoto." Descubrimos que la reacción de oligomerización también se desarrolló en condiciones químicas similares a las de la Tierra antes de que surgiera la vida, utilizando componentes de reacción como mineral de hierro y ácido sulfúrico, que podría haberse generado a partir de gas volcánico ".
Por lo tanto, el trabajo del equipo proporciona no solo una herramienta de laboratorio eficiente para una variedad de aplicaciones prácticas, pero también un posible atisbo de la química a partir de la cual comenzó la vida.