
Experimento de luz solar. Las reacciones se pueden realizar utilizando la luz del sol en un simple frasco de vidrio. Crédito:J. Waser / EPFL
Descubrir nuevos objetivos biológicos es una parte fundamental de nuestra batalla en curso contra las enfermedades. A través de los años, los científicos han logrado un progreso impresionante hacia la comprensión de los sistemas biológicos, identificando constantemente nuevos objetivos. La diversidad estructural de estos objetivos requiere una amplia gama de agentes terapéuticos diferentes.
"Las pequeñas moléculas sintéticas siguen siendo actores clave, pero biomoléculas como péptidos, las proteínas y los oligonucleótidos se han convertido en un área importante de investigación, "dice el profesor Jérôme Waser, director del Laboratorio de Catálisis y Síntesis Orgánica de la EPFL. Los péptidos son particularmente interesantes, con alrededor de 140 evaluados en ensayos clínicos en 2015. Sin embargo, Los péptidos a menudo no son estables en la sangre y no pueden penetrar bien en las células. ambos disminuyen su uso potencial como drogas.
Una solución para superar estas dificultades es modificar químicamente la estructura natural de los péptidos, un proceso llamado "funcionalización". En Quimica, una molécula se "funcionaliza" añadiéndole grupos químicos, dotándolo así de nuevas funciones, capacidades, o propiedades, como una mayor estabilidad en el cuerpo humano. Sin embargo, la funcionalización de péptidos es difícil, debido a su compleja estructura.
"La razón principal es la falta de selectividad cuando se intenta modificar un péptido:contiene muchas posiciones que reaccionan con sustancias químicas, resultando en mezclas inútiles, "explica Waser". Por lo tanto, se buscan activamente métodos que permitan la funcionalización selectiva de una sola posición en péptidos para acceder a fármacos basados en péptidos estables para hormigas más eficientes ".
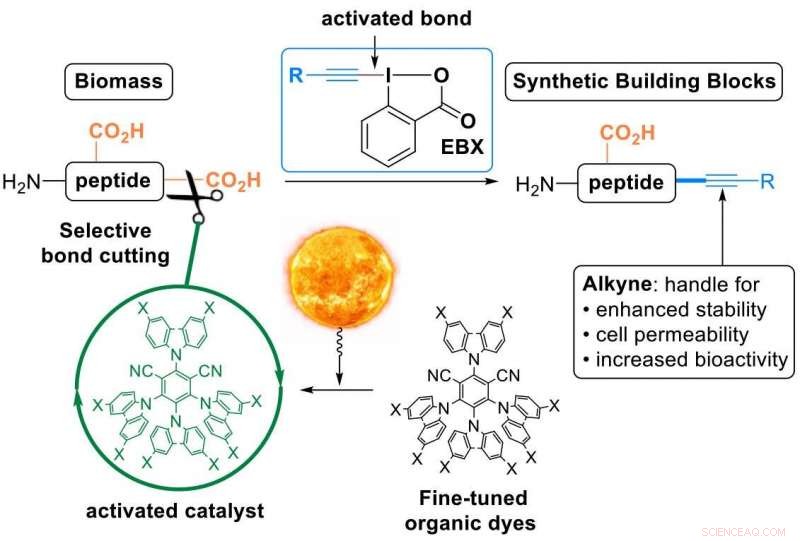
Esto es lo que ha logrado el laboratorio de Waser, utilizando "reactivos EBX", una clase de compuestos orgánicos muy reactivos desarrollados por el grupo y ahora disponibles comercialmente. Usando esos reactivos, los investigadores convirtieron el ácido carboxílico C-terminal de los péptidos en un triple enlace carbono-carbono, un alquino (en la jerga química una "alquinilación descarboxilativa"). El resto alquino es un grupo funcional muy valioso que se puede usar para modificar aún más los péptidos. Se ha utilizado ampliamente en el descubrimiento de fármacos, ciencias de los materiales y biología química.
Uniendo el mundo natural y sintético en un solo paso:Modificación de péptidos usando tintes orgánicos excitados con luz visible y reactivos EBX. Crédito:J. Waser / EPFL
Los péptidos no reaccionan espontáneamente con los reactivos EBX, por lo que los científicos tuvieron que usar un catalizador. Para activarlo, los investigadores se volvieron hacia la luz o, en términos más técnicos, "catálisis fotorredox":la luz visible es absorbida por el catalizador, que luego activa selectivamente un enlace en las moléculas que reaccionan. "El uso de la luz como fuente de energía renovable para realizar reacciones orgánicas permite una resolución temporal y espacial con condiciones de reacción muy suaves, "dice Waser.
Los investigadores hicieron dos innovaciones:primero, diseñaron tintes orgánicos novedosos y afinados como catalizadores fotorredox. Esto fue importante ya que las reacciones mediadas por la luz se basan generalmente en casos raros, catalizadores de metales de transición tóxicos y costosos.
Segundo, los investigadores lograron esta primera "alquinilación descarboxilativa" en péptidos nativos. Se trata de una transformación en un solo paso especialmente atractiva de un compuesto natural en un derivado sintético, ya que ofrece una plataforma para modificar las propiedades físicas y químicas del péptido a través de un único, manipulación fácil (todos los "ingredientes" solo deben mezclarse y dejar reposar a la luz natural).
El método se puede utilizar con casi todos los aminoácidos presentes en los péptidos, mientras se mantiene una selectividad completa hacia la posición C-terminal sobre las cadenas laterales del péptido.
Con su nuevo método, Los científicos también pudieron obtener derivados del valioso péptido bioactivo GRGDNP que impide que las células se adhieran a la fibronectina. un proceso importante en la vasodilatación de los vasos sanguíneos, lo que podría ser de gran utilidad en el estudio de las enfermedades cardiovasculares.