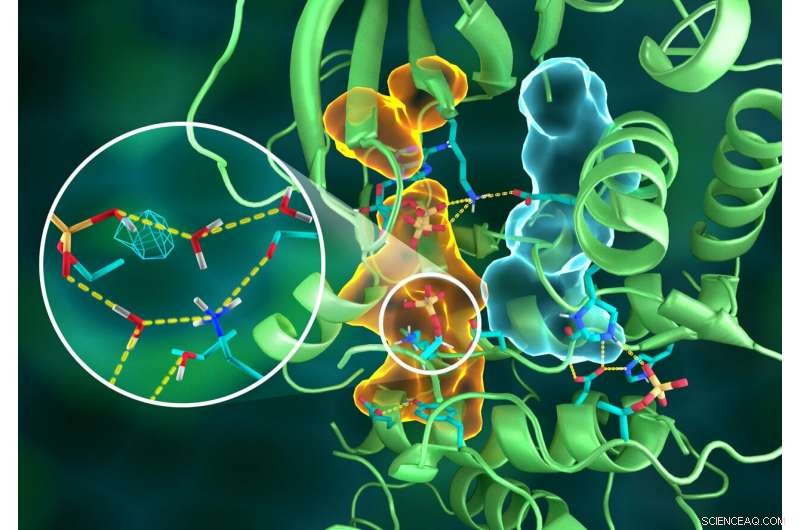
Ilustración de la intrincada organización de la estructura PKA, donde diferentes partes de la proteína están conectadas a través de elaboradas redes de enlaces de hidrógeno (líneas amarillas discontinuas), pegados por los conjuntos hidrofóbicos (volúmenes azul claro y naranja), todos trabajando juntos para construir el sitio activo funcional. El inserto muestra la protonación del grupo fosforilo transferido (malla cian) y sus muchas interacciones con el agua y los residuos de aminoácidos del sitio activo. Crédito:ORNL / Jill Hemman
Las observaciones directas de la estructura y el mecanismo catalítico de una enzima quinasa prototípica, la proteína quinasa A o PKA, proporcionarán a los investigadores y desarrolladores de fármacos capacidades significativamente mejoradas para comprender y tratar enfermedades mortales y trastornos neurológicos como el cáncer. diabetes, y fibrosis quística.
El descubrimiento fue realizado por un equipo internacional de investigadores utilizando cristalografía de neutrones macromoleculares en el Laboratorio Nacional de Oak Ridge del Departamento de Energía y el Institut Laue-Langevin en Grenoble. Francia. Sobre la base de una investigación de una década, los esfuerzos combinados revelaron características previamente desconocidas de la proteína quinasa arquetípica, que incluye un mapa completo de la estructura atómica y los fundamentos de la química de la enzima utilizada en la señalización celular. Los detalles se publican en la revista. Avances de la ciencia .
Las quinasas son un gran grupo de cientos de enzimas responsables de iniciar y regular innumerables procesos celulares. Las quinasas envían señales a las proteínas por medio de la fosforilación, agregando un grupo químico reactivo que consiste en fósforo y oxígeno a una ubicación específica en una proteína sustrato para activar su función biológica específica.
Los problemas surgen cuando las mutaciones genéticas hacen que las quinasas funcionen incorrectamente, que a su vez conduce a la enfermedad. Una quinasa que funciona mal, o uno que no se puede desactivar, podría ser responsable de la sobreexpresión de proteínas que conducen a la propagación incontrolable de las células cancerosas. Lo contrario también es cierto en los trastornos neurológicos en los que una quinasa que funciona mal simplemente hace que las células mueran.
"La creación de fármacos que se dirijan a quinasas específicas es extremadamente importante, ", dijo el coautor Andrey Kovalevsky." Esta comprensión detallada de la estructura de la PKA y su dinámica nos dirá más sobre otros tipos de quinasas y debería ayudar a los desarrolladores de fármacos a diseñar nuevos fármacos con mejor especificidad, lo que finalmente se traduciría en terapias más precisas con menos efectos secundarios ".
Los cambios en la estructura de la proteína debidos a mutaciones pueden ser difíciles de detectar, aunque los efectos de las mutaciones en el comportamiento dinámico de la proteína pueden ser bastante profundos. Sin embargo, Estos comportamientos dinámicos se vuelven más evidentes al examinar la red general de enlaces de hidrógeno a lo largo de la proteína.
Los neutrones son especialmente sensibles a elementos ligeros como el hidrógeno. Debido a que aproximadamente el 50 por ciento de todos los átomos de las proteínas son hidrógeno, y la mayoría de las reacciones químicas que catalizan las enzimas involucran hidrógeno, Los neutrones son una sonda ideal e insuperable para detectar las posiciones de los átomos de hidrógeno dentro de la estructura de la proteína y rastrear su movimiento durante la catálisis.
Difracción de neutrones utilizando el difractómetro IMAGINE en el reactor de isótopos de alto flujo de ORNL, una instalación para usuarios de la Oficina de Ciencias del DOE, y el difractómetro LADI-III en ILL permitió a los investigadores ver las posiciones exactas de los átomos de hidrógeno para revelar la estructura completa de la quinasa, así como los estados de protonación de todos los aminoácidos en PKA y los ligandos unidos a su sitio activo. muchos de los cuales eran previamente desconocidos.
"Los neutrones nos permitieron validar las predicciones de rayos X de las posiciones de los átomos de hidrógeno, así como determinar los estados de protonación de grupos químicos que no se conocían, o en lugares donde no esperábamos encontrarlos. Este importante avance químico allana el camino para estudios de simulación y modelado molecular más sofisticados de la estructura y función de la proteína quinasa. "dijo la autora correspondiente Susan Taylor.
"Los neutrones ofrecen una vista sin precedentes de la red de enlaces de hidrógeno que rodea y dentro del sitio activo de PKA y brindan información crucial sobre cómo se produce la transmisión alostérica de información a través de la estructura de la proteína, ", añadió el coautor Gianluigi Veglia." La combinación de la cristalografía de neutrones con la espectroscopia de resonancia magnética nuclear proporcionará una comprensión completa de cómo funcionan las enzimas ".