
Crédito:Universidad de Leiden
Después de casi cuatro décadas, Los químicos de Leiden y Eindhoven han resuelto la discusión sobre el modelo correcto con respecto a la reacción química más simple en catálisis heterogénea, que es esencial para las pilas de combustible. Usando una superficie de platino curva única, Ludo Juurlink y Ph.D. el candidato Richard van Lent de Leiden y Michael Gleeson de DIFFER mostraron qué modelo describe correctamente la reacción del hidrógeno. Publicaron sus hallazgos en Ciencias el 11 de enero.
Durante casi cuatro décadas ha habido un acalorado debate en la literatura química:¿cuál de los dos modelos existentes para la reacción del hidrógeno a un catalizador de platino es el correcto (ver recuadro)? Los métodos tradicionales no fueron suficientes para demostrarlo. El químico de Leiden Ludo Juurlink y Michael Gleeson del Instituto Holandés de Investigación de Energía Fundamental (DIFFER) decidieron desarrollar un nuevo método para proporcionar evidencia concluyente, que resultó ser un éxito.
Los dos modelos existentes de catálisis heterogénea dan diferentes predicciones sobre cómo la reacción del hidrógeno depende de la estructura de la superficie del platino. Mediante mediciones, los investigadores pudieron determinar la reactividad del hidrógeno y así probar qué modelo es el correcto. El cristal de platino curvado fue crucial para esto, que fue fabricado por la empresa holandesa en Zaandam por primera vez. "Debido a que la superficie de platino es curva, la estructura atómica cambia muy gradualmente a lo largo de la superficie, "explica Juurlink." Puedes comparar esta estructura con una escalera, cuyos pasos hacia los bordes se vuelven cada vez más estrechos. En el medio se parece más a un salón de baile ". Resultó que la reactividad del hidrógeno era linealmente dependiente de lo cerca que estaban los pasos entre sí. Cuanto más separados estaban los pasos, el hidrógeno menos reactivo era. "Entonces, el modelo que predijo un comportamiento no lineal es incorrecto, " él dice.
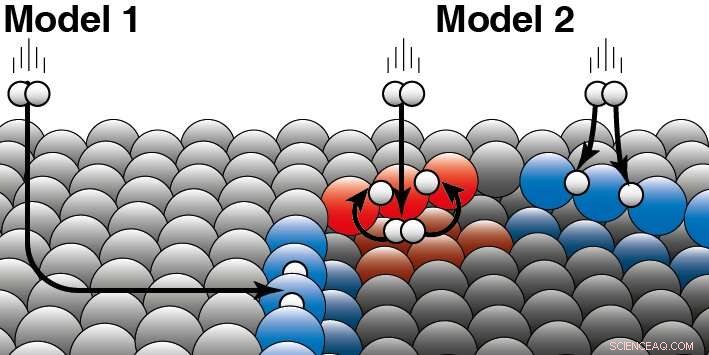
Un catalizador acelera una reacción química sin consumirse. En catálisis heterogénea, el catalizador suele ser un sólido y los reactivos un gas o un líquido. Juurlink explica la diferencia entre los dos modelos:"Los dos modelos se basan en diferentes suposiciones sobre cómo la energía cinética de la molécula de hidrógeno se" escapa "durante la colisión con la superficie del platino. Para aclarar esto, da un ejemplo:'Si un perro está en un agujero de hielo, pudo haber terminado allí de dos maneras. O se resbaló sobre el hielo por un lado y cayó en el agujero de hielo, o saltó directamente al agujero de hielo desde un lado '. Su investigación ahora muestra que las moléculas de hidrógeno reaccionan principalmente directamente fuera de la fase gaseosa en el borde del paso del platino (Modelo 2). Modelo 1, eso supone que la mayoría de las moléculas terminan en los bordes "patinando" sobre la superficie plana de platino y solo entonces reaccionan, por lo tanto, no es correcto. Los investigadores vieron diferencias entre los dos tipos diferentes de bordes (rojo y azul) que ocurren naturalmente en los catalizadores de platino. El hidrógeno puede aterrizar en la parte superior o inferior de dicho borde. Para ambos tipos de bordes escalonados, los investigadores pueden decidir qué parte reacciona directamente en el lado superior (como se ilustra en azul) o aterriza primero en el lado inferior (como en rojo). Crédito:Universidad de Leiden
La investigación se llevó a cabo en un vacío ultra alto y proporciona información importante. "Ahora sabemos mejor cómo calcular la velocidad de las reacciones químicas:uno de los modelos no contribuye significativamente, "dice Juurlink". Además, ahora sabemos que estas superficies de cristal curvas ofrecen una nueva oportunidad de aprender cómo ocurren realmente las reacciones químicas en las superficies. Ciertamente vamos a hacer más investigaciones con eso ".
Casi todos los procesos industriales químicos importantes utilizan catálisis heterogénea. Los catalizadores a veces son caros y raros, como el platino, un catalizador común que se encuentra en las pilas de combustible y los sistemas de escape de los automóviles. "Lo inusual es que, por lo general, ni siquiera sabemos realmente cómo y por qué tales catalizadores aceleran las reacciones químicas, ", dice Juurlink. Una mejor comprensión de este cómo y por qué contribuirá a hacer que la industria química sea más sostenible". Basado en una mejor comprensión de lo que está sucediendo a nivel atómico, podemos desarrollar nuevos catalizadores, ", dice Juurlink." Catalizadores que causan menos pérdida de energía y son menos dependientes de materiales raros y costosos ".