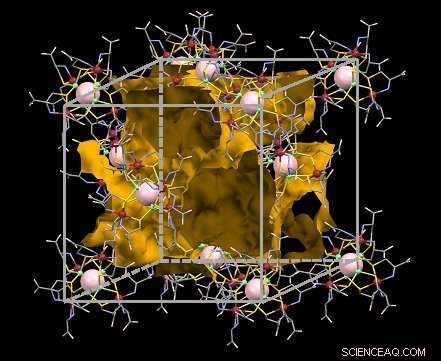
Figura 1:Estructura del cristal iónico recientemente desarrollado. La vía por la que pueden viajar los iones está resaltada en amarillo. Crédito:Universidad de Osaka
Un equipo de investigación de la Universidad de Osaka ha informado de un nuevo avance en el diseño de materiales para su uso en baterías recargables, en condiciones de alta humedad. Inspirándose en células vivas que pueden bloquear partículas más pequeñas pero dejar pasar partículas más grandes, los investigadores pudieron crear un material con iones de potasio altamente móviles que pueden migrar fácilmente en respuesta a campos eléctricos. Este trabajo puede ayudar a que las baterías recargables sean lo suficientemente seguras y económicas como para reducir drásticamente el costo de los automóviles eléctricos y los dispositivos electrónicos portátiles de consumo.
Las baterías recargables de iones de litio se utilizan ampliamente en computadoras portátiles, celulares, e incluso coches eléctricos e híbridos. Desafortunadamente, estas baterías son caras, e incluso se sabe que estallan en llamas en ocasiones. Los nuevos materiales que no usan litio podrían reducir el costo y mejorar la seguridad de estas baterías, y tienen el potencial de acelerar enormemente la adopción de coches eléctricos energéticamente eficientes. Tanto los iones de sodio como los de potasio son candidatos potenciales que pueden usarse para reemplazar el litio, ya que son baratos y abundan. Sin embargo, Los iones de sodio y potasio son iones mucho más grandes que el litio, por lo que se mueven lentamente a través de la mayoría de los materiales. Estos iones positivos se ralentizan aún más por las fuertes fuerzas de atracción de las cargas negativas en los materiales cristalinos. "Los iones de potasio poseen baja movilidad en estado sólido debido a su gran tamaño, que es una desventaja para construir baterías, "explica el autor correspondiente Takumi Konno.
Para resolver este problema, Los investigadores utilizaron el mismo mecanismo que emplean sus células para permitir que los iones de potasio grandes pasen a través de sus membranas y, al mismo tiempo, impidan la entrada de partículas más pequeñas. Los sistemas vivos logran esta hazaña aparentemente imposible al considerar no solo los iones en sí, sino también las moléculas de agua circundantes, llamada "capa de hidratación, "que se sienten atraídos por la carga positiva del ion. De hecho, cuanto más pequeño es el ion, cuanto más grande y más unida será su capa de hidratación asociada. Los canales de potasio especializados en las membranas celulares tienen el tamaño adecuado para permitir el paso de los iones de potasio hidratados. pero bloquea las grandes capas de hidratación de iones más pequeños.

Figura 2:Conductividades del litio (Li +, rojo), sodio (Na +, verde), y potasio (K +, azul) dentro del cristal a diferentes temperaturas. Las conductividades aumentan incluso cuando aumentan los tamaños de los iones. Crédito:Universidad de Osaka
Los investigadores desarrollaron un cristal iónico utilizando rodio, zinc, y átomos de oxígeno. Al igual que con los canales biológicos selectivos, se encontró que la movilidad de los iones en el cristal era mayor para los iones de potasio más grandes, en comparación con los iones de litio más pequeños. De hecho, los iones de potasio se movían con tanta facilidad, el cristal fue clasificado como "conductor superiónico". Los investigadores encontraron que el material actual tenía la mayor movilidad de iones de potasio hidratado jamás vista hasta la fecha.
"Notablemente, el cristal exhibió una conductividad iónica particularmente alta debido a la rápida migración de iones de potasio hidratados en la red cristalina ", dice el autor principal, Nobuto Yoshinari." Esta conductividad superiónica de los iones de potasio hidratados en estado sólido no tiene precedentes, y puede conducir a baterías recargables más seguras y más baratas ".