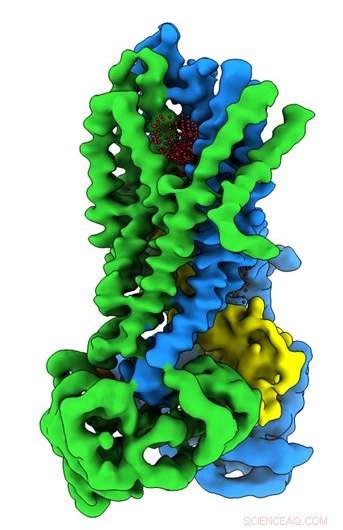
Crédito:Universidad de Carolina del Norte en Chapel Hill School of Medicine
Los científicos de la Facultad de Medicina de la UNC, en colaboración con los investigadores de la Universidad de Salud y Ciencia de Oregon, han resuelto la estructura molecular tridimensional de la proteína que es defectuosa en personas con fibrosis quística en estado activo e inactivo de la proteína. El descubrimiento, publicado en la revista Bioquímica , podría abrir nuevas vías de investigación y ayudar a los desarrolladores de medicamentos a crear farmacoterapias mejoradas para ayudar a las personas con FQ.
Gran parte del trabajo de bioquímica se realizó en el laboratorio de John Riordan, Doctor, profesor distinguido de bioquímica y biofísica en UNC-Chapel Hill. A finales de la década de 1980, El laboratorio de Riordan descubrió el gen mutado responsable de la FQ. Si un niño recibe una copia de este gen defectuoso de cada padre, el niño desarrollará FQ. La proteína codificada por este gen se denominó regulador transmembrana de la fibrosis quística, o CFTR, que es el canal de cloruro en las células epiteliales que pueblan el sistema respiratorio. Las personas con FQ carecen de un canal de cloruro epitelial funcional, que es esencial para mantener el equilibrio adecuado de sal y agua en los pulmones y otros órganos. Un resultado de esto es la producción de espeso, moco pegajoso que se vuelve difícil de sacar de las vías respiratorias, provocando infecciones crónicas y una vida útil más corta para la mayoría de las personas con FQ.
En el laboratorio de Riordan, becario postdoctoral Jonathan Fay, Doctor, Lideró experimentos utilizando microscopía crioelectrónica de una sola partícula para descubrir la estructura molecular de CFTR en presencia de ATP, una sustancia química orgánica compleja necesaria para muchos procesos en las células. incluyendo un canal de iones de cloruro en funcionamiento, crucial para el correcto funcionamiento de los pulmones. Para ayudar a capturar las estructuras de la proteína CFTR en su estado activo e inactivo, el laboratorio de Riordan estabilizó la proteína CFTR de manera que el canal estaba apagado cuando se desfosforilaba y se bloqueaba cuando se fosforilaba.
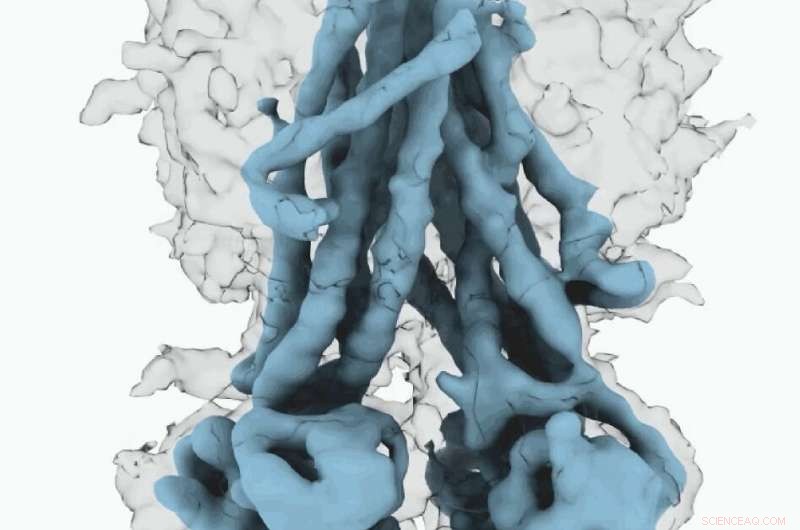
Mapa Cryo-EM de CFTR. Crédito:Universidad de Carolina del Norte en Chapel Hill School of Medicine
Estas estructuras moleculares revelan un reposicionamiento único de partes de la proteína CFTR, proporcionando información sobre la transición estructural entre los estados funcionales activo e inactivo de CFTR.
Es más, Fay y sus colegas observaron detalles de este complejo de proteínas que difieren de lo que otros científicos han descubierto en estructuras CFTR anteriores.
"Es realmente sorprendente cuánto han avanzado las tecnologías crio-EM y cómo el uso de estas técnicas puede permitirnos visualizar diferentes estados del canal, "Dijo Fay." Creo que nuestros resultados son muy emocionantes. Descubrimos un nuevo portal que presenta una nueva área prometedora del canal para apuntar y controlar la función del canal CFTR ".
Y si los investigadores pueden orientar y controlar con éxito la función de ese canal, entonces podrían crear terapias más precisas para tratar mejor a algunas personas con FQ.