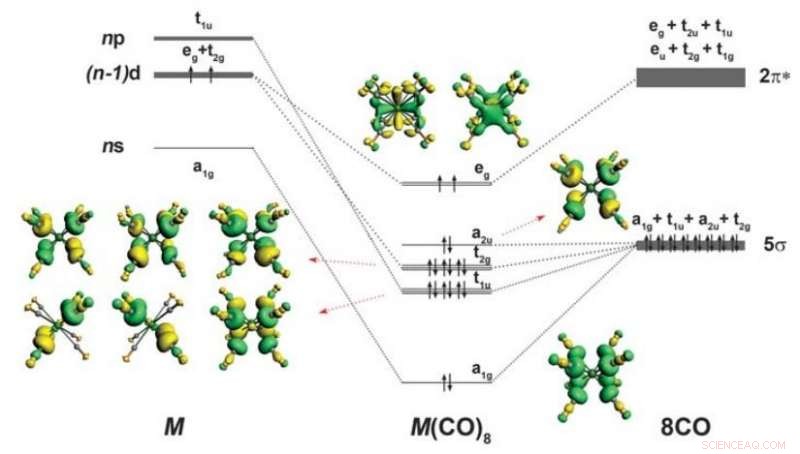
Esquema de enlace y forma de los orbitales de valencia ocupados de M (CO) 8 (M =Ca, Sr, o Ba). División de los orbitales de valencia spd de un átomo M con la configuración (n - 1) d 2 ns 0 notario público 0 en el octacoordinado cúbico (O h ) También se proporciona el campo de ocho ligandos de CO. Solo se muestran los orbitales de valencia ocupados que son relevantes para las interacciones M-CO. Las flechas hacia arriba y hacia abajo indican electrones con espín opuesto. Crédito: Ciencias (2018). DOI:10.1126 / science.aau0839
Un equipo de investigadores de la Universidad de Fudan y la Universidad Tecnológica de Nanjing, ambos en China, ha demostrado que el principio de los 18 electrones no se limita a los metales de transición. En su artículo publicado en la revista Ciencias , el grupo describe su trabajo con el calcio, átomos de estroncio y bario y lo que encontraron. P. B. Armentrout, de la Universidad de Utah, ofrece un artículo en perspectiva sobre el trabajo realizado por el equipo en China en el mismo número de la revista.
Como recordarán muchos estudiantes de química, Los elementos de la tabla periódica se clasifican en elementos del grupo principal divididos por bloques:incluyen los bloques s y p, el bloque d, que incluye metales de transición, y por supuesto, el bloque f, que incluye actínidos y lantánidos. También, los principales elementos del grupo calcio, Se sabe que el estroncio y el bario forman enlaces utilizando sus orbitales, y siga lo que se conoce como la regla del octeto, donde los átomos terminan con ocho electrones en su capa de valencia. Metales de transición, por otra parte, tienen otros cinco orbitales d que cuando se llenan dan como resultado una formación estable con 18 electrones. En este nuevo esfuerzo, los investigadores han demostrado que incluso los elementos del grupo principal, como el calcio, el estroncio y el bario pueden seguir la regla del octeto, demostrando que la regla del octeto no se limita solo a los metales de transición. El grupo sugiere que este hallazgo indica que la antigua regla del octeto, que se encuentra en prácticamente todos los libros de texto de química, no es realmente correcto en algunos casos.
En su trabajo, Los investigadores demostraron que los elementos del grupo principal podían formar complejos de 18 electrones con monóxido de carbono cuando se colocaban en una cámara muy fría. Informan que estaban estudiando Ba (CO) + y Ba (CO) - utilizando análisis espectral cuando encontraron algo mal, los números de onda para el modo de estiramiento C-O se cambiaron de manera extraña. Un análisis de sus hallazgos sugirió que los átomos de Ba tenían orbitales d en lugar de los orbitales s o p esperados. Para demostrar sus hallazgos teóricos, pusieron mezclas de Ba, Sr y Ca en una matriz de neón frío y utilizaron espectroscopía infrarroja para ver mejor lo que estaba sucediendo (encontraron evidencia de ocho ligandos de CO y enlaces de retorno), una demostración de metales sin transición siguiendo la regla del octeto.
© 2018 Phys.org