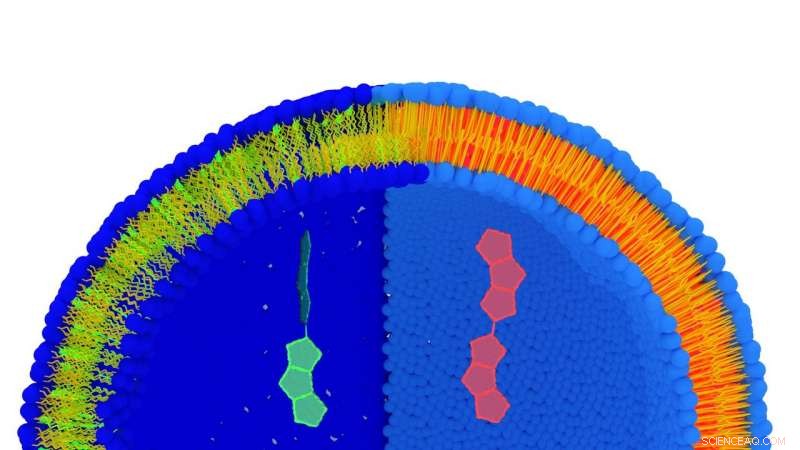
Vista del artista de una membrana lipídica marcada con la molécula FliptR. Los lípidos son azules (parte hidrofílica) y amarillos (parte hidrofóbica). Cuando los lípidos se estiran (parte izquierda), la molécula tiene una vida corta (verde), mientras que cuando los lípidos son más compactos, su tiempo de vida es largo (rojo). Ambas conformaciones se muestran a gran escala en el centro de la imagen. Crédito:© UNIGE
El volumen de células puede variar drásticamente. Similar a un globo inflado, el aumento de volumen de las células en crecimiento empuja la membrana plasmática, la envoltura lipídica que rodea la célula. Esta presión de "turgencia" aumenta la tensión de la membrana, cuales, si no se corrige, finalmente hará que la celda explote. Para evitar que esto suceda, las células han desarrollado mecanismos para controlar la tensión de su membrana plasmática. Cuando la tensión es demasiado alta, las células responden aumentando la cantidad de lípidos en la membrana. En cambio, cuando la tensión es demasiado baja, las células eliminan los lípidos de la membrana para "tensarla". La forma en que las células logran detectar la tensión y desencadenar la respuesta biológica adecuada sigue siendo un misterio. Ha sido difícil de resolver debido a la falta de herramientas para estudiar la tensión de la membrana dentro de las células vivas. Para abordar este problema, Investigadores de la Universidad de Ginebra (UNIGE) y el Centro Nacional de Competencia en Investigación de Biología Química (NCCR) han colaborado para crear una molécula fluorescente para medir la tensión de la membrana plasmática de células vivas. Usando esta nueva herramienta, luego pudieron descubrir cómo las células adaptan su superficie a su volumen. Estos resultados, publicado en Química de la naturaleza y Biología celular de la naturaleza , allanar el camino para muchas aplicaciones, incluso en la detección de células cancerosas que normalmente muestran una tensión de membrana aberrantemente alta.
Cuando aumenta el volumen de una celda, aumenta la tensión ejercida sobre su membrana, provocando la activación de TORC2, un complejo de proteínas que crea señales de advertencia dentro de la célula. "La membrana celular consta de lípidos organizados en una bicapa semipermeable, "explica Aurélien Roux, profesor del Departamento de Bioquímica de la Facultad de Ciencias de la UNIGE y miembro del NCCR. "Esta superficie es fluida, permitiendo una gran adaptabilidad de la membrana a los cambios en la forma y el volumen de la célula. Como cualquier superficie, se puede estirar y luego aumenta el espacio entre los lípidos. Cuando este espacio se vuelve demasiado grande y la membrana está en peligro de romperse, una proteína, llamado Slm1, activa TORC2 para producir señales que empujan a la célula a producir nuevos lípidos y, a su vez, reducir la tensión de la membrana celular ". Pero, ¿cómo podrían los investigadores medir la tensión necesaria para desencadenar este proceso?
Para evaluar la tensión de la membrana celular, es necesario poder medir el espacio entre los lípidos que constituyen esta membrana. Stefan Matile, profesor del Departamento de Química Orgánica de la Facultad de Ciencias de la UNIGE y miembro del NCCR, ha creado una "molécula sonda" llamada FliptR (Fluorescent Lipid Tension Reporter), que se integra espontáneamente entre los lípidos de la membrana plasmática. "Hemos desarrollado una molécula fluorescente con dos pequeñas" aletas "que definen un cierto ángulo entre ellas, el explica. Este ángulo varía según la presión ejercida sobre FliptR, que cambia su fluorescencia ". Aprovechando esta diferencia en las propiedades de fluorescencia de la molécula, el grupo del profesor Roux pudo medir el espacio entre los lípidos y por tanto la tensión de una membrana.
FliptR es una nueva herramienta valiosa para medir la tensión de la membrana plasmática en células vivas. "Sabemos que las células cancerosas tienen una tensión de membrana más alta que las células normales. Esperamos que esta molécula fluorescente algún día ayude a detectarlas más fácilmente, "dice Stefan Matile.
¿Y a la hora de reducir la tensión de la célula?
Cuando aumenta la tensión de la membrana plasmática, TORC2 se activa y esto desencadena la producción de lípidos para reducir la tensión a los valores basales. Pero, ¿qué sucede cuando la tensión de la membrana es demasiado baja y hay que aumentarla? "Inicialmente pensamos que estaba sucediendo a través del mismo mecanismo funcionando a la inversa, pero la historia resultó ser mucho más interesante, "dice Robbie Loewith, profesor del Departamento de Biología Molecular de la Facultad de Ciencias de la UNIGE y también miembro del NCCR. En efecto, La investigación inicial mostró que el activador de TORC2 Slm1, involucrado en la detección de alta tensión de la membrana, sorprendentemente no juega ningún papel en la respuesta a muy poca tensión. "Por otra parte, observamos que un lípido particular presente en la membrana plasmática, llamado PIP2, es el sensor de baja tensión de la membrana ".
Cuando la tensión de la membrana disminuye, PIP2, previamente mezclado con otros lípidos, se auto-segrega para formar "islas" PIP2 en un mar de lípidos remanentes en la membrana, en un proceso similar a la separación espontánea (subida) de la nata en leche fresca. Como una de las proteínas de TORC2 se une a PIP2, TORC2 también se redistribuye a estos islotes PIP2. Una vez engullido por estos islotes, TORC2 se desactiva. "Los lípidos de la membrana celular se degradan naturalmente, y la actividad TORC2 es necesaria para reemplazarlos ", explica Robbie Loewith. Pero cuando se inhibe TORC2 dentro de los islotes PIP2, los lípidos degradados ya no se reemplazan, resultando en un aumento en la tensión de la membrana plasmática. Si este proceso de recalibración está bloqueado, las células no pueden ajustar la tensión de su membrana plasmática y mueren.
Una herramienta de medición química para ayudar a la investigación en biología.
Gracias a la técnica de medición de tensión desarrollada por Stefan Matile y Aurélien Roux, los equipos de los profesores Roux y Loewith pudieron realizar sus experimentos con levaduras y medir las variaciones de tensión de la membrana plasmática. La tensión de la membrana es un parámetro muy importante a controlar en todos los procesos celulares en los que intervienen las membranas. como la motilidad, endocitosis (el proceso a través del cual la célula se alimenta a sí misma), o división celular, y especialmente en el caso del desarrollo del cáncer. Los científicos ahora se están enfocando en verificar si el mecanismo observado en la levadura es el mismo en las células humanas, con la idea a largo plazo de desarrollar fármacos capaces de regular TORC2, o incluso de prevenir el desarrollo de ciertos cánceres.