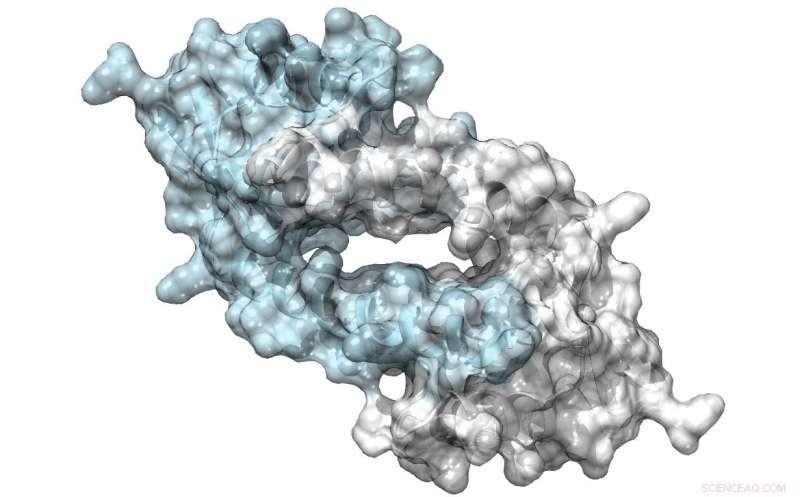
Estructura de LmrR, una proteína con un poro grande en su interfaz de dímero, que pueden unirse a antibióticos o reclutar sustratos para someterse a catálisis. Crédito:Clemens Mayer / Universidad de Groningen
Los químicos de la Universidad de Groningen han creado una nueva enzima con un aminoácido no natural como centro activo. Hicieron la enzima modificando una proteína de unión a antibióticos que normalmente actúa como un factor de transcripción bacteriano. Otras modificaciones del sitio reactivo pueden crear diferentes enzimas para su uso en síntesis química. Se publicó una descripción de la nueva enzima en Química de la naturaleza el 2 de julio.
La industria química está trabajando duro para reemplazar los procesos convencionales, que puede utilizar sustancias químicas tóxicas o mucha energía, con alternativas más amigables con el medio ambiente. Una alternativa popular son las enzimas, que suelen funcionar en agua a temperaturas moderadas. Sin embargo, el número de reacciones catalizadas por enzimas naturales es limitado en comparación con lo que está disponible en química. "Es por eso que el diseño de enzimas realmente ha despegado en los últimos años, ", dice el profesor de química biomolecular de la Universidad de Groningen, Gerard Roelfes.
Mayor catálisis
Las enzimas se pueden diseñar de diferentes formas. Todavía, hasta aquí, sólo se han utilizado los 20 aminoácidos naturales para crear el sitio activo de las enzimas. Esto limita el número de reacciones que pueden realizar estas enzimas diseñadas, Roelfes sostiene:"Creemos que la incorporación de aminoácidos no estándar en las proteínas podría expandir significativamente el repertorio de enzimas de diseño".
Su equipo utilizó un factor de transcripción bacteriano como punto de partida para su diseño. La proteína LmrR es un regulador transcripcional en la bacteria Lactococcus lactis, que responde a los antibióticos; no cataliza reacciones químicas por sí mismo. Es un dímero en forma de rosquilla con una abertura central que une moléculas hidrófobas. Utilizando técnicas de código genético ampliado, Roelfes y sus colegas introdujeron el aminoácido no natural p-aminofenilalanina en la proteína de tal manera que la anilina de la cadena lateral estaba presente en la abertura central. "La anilina es un catalizador conocido en la síntesis química, pero no muy potente. Introduciéndolo en la proteína LmrR, aumento de la catálisis en casi tres órdenes de magnitud ".

Estructura de la proteína LmrR del poro. Cuando un aminoácido no natural, p-aminofenilalanina, se introduce en este poro, la actividad catalítica inherente de la cadena lateral de la anilina (estructura roja) aumenta en casi tres órdenes de magnitud para la formación de una hidrazona modelo. Crédito:Clemens Mayer / Universidad de Groningen
Diferentes reactividades
La nueva enzima une moléculas orgánicas formando una estructura de hidrazona, una reacción que se utiliza en biotecnología médica, por ejemplo, para acoplar fármacos a anticuerpos. "En nuestros experimentos, utilizamos una reacción que da un producto de color agradable, por lo que podríamos medir fácilmente la actividad de la nueva enzima ". Roelfes y su equipo ahora están modificando la abertura central para aumentar la eficiencia de la enzima y adaptarla a reacciones específicas.
"Hay muchas opciones para utilizar este diseño de enzima en la síntesis química, ", dice Roelfes" Y también podríamos introducir otros aminoácidos no naturales que tienen diferentes reactividades ". Combinando estas nuevas propiedades catalíticas con el sitio de unión promiscuo de la proteína LmrR, Roelfes confía en que se pueden crear muchas nuevas enzimas útiles.