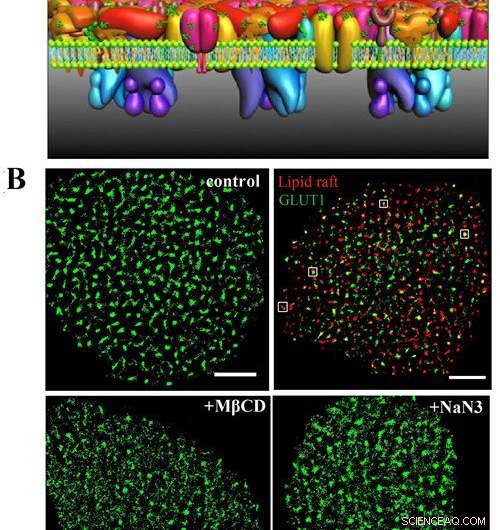
A) Este es el modelo PLLPI de la membrana celular. B) imágenes dSTORM de GLUT1 en la membrana celular; GLUT1 y balsas lipídicas; y distribución de GLUT1 después del tratamiento con MβCD y NaN3. Barras de escala, 5 μm. Crédito:GAO Jing
La glucosa es la principal fuente de energía y sustrato de las células. y su captación a través de la membrana plasmática celular depende en gran medida de la familia del transporte de glucosa (GLUT). GLUT1, uno de los miembros de la familia GLUT, es una proteína de membrana expresada de forma ubicua. Es responsable de la captación constante de glucosa en muchos tejidos.
Yan y col. informó la estructura cristalina de GLUT1 humano a una resolución de 3,2 angstrom en 2014. Sin embargo, la distribución detallada de GLUT1 en las membranas celulares nativas no estaba clara, y se desconocía cómo las organizaciones de proteínas se vinculan con sus funciones fisiológicas. Con la modificación y actualización de la estructura de la membrana celular, muchos estudios han encontrado la distribución heterogénea y agrupada de proteínas de membrana.
Un modelo reciente de membrana de capa de proteína-lípido-isla de proteína (PLLPI) enfatizó que se formó una capa de proteína densa en el lado ectoplásmico de la membrana y se formaron microdominios de proteína dispersos en el lado citoplásmico. Para abordar las características de distribución y los mecanismos de organización subyacentes de GLUT1, La microscopía de fluorescencia de superresolución ha proporcionado una herramienta particularmente adecuada. Rompe la barrera de la difracción y alcanza una resolución lateral de decenas de nanómetros. Es muy adecuado para controlar directamente el tamaño y la estabilidad de las agregaciones de proteínas.
Prof. WANG Hongda del Instituto de Química Aplicada de Changchun, Academia de Ciencias de China y el profesor XIONG Wenyong del Instituto de Botánica de Kunming, junto con los miembros de su equipo, Primero investigó la distribución y ensamblaje de GLUT1 a una resolución nanométrica mediante microscopía de reconstrucción óptica estocástica directa (dSTORM).
Descubrieron que el transportador formaba grupos con un diámetro promedio de ~ 250 nm en las membranas de las células HeLa. Hubo una asociación espacial precisa entre GLUT1 y balsas lipídicas, que resolvió el debate en torno a la localización del transportador en dominios de membrana.
En cuanto al mecanismo organizativo de los clústeres GLUT1, revelaron que no solo el entorno de las balsas lipídicas puede estabilizar su existencia, pero el citoesqueleto de actina y la N-glicosilación también juegan un papel importante en la formación de los grupos.
Es más, encontraron que la activación de GLUT1 por azida de sodio o MβCD no aumentaba su expresión en la membrana, pero inducía la disminución de los grandes grupos.
Los resultados sugirieron una posible asociación entre distribución y activación. El trabajo de sus equipos puede constituir un paso adelante en nuestra comprensión del mecanismo molecular del agrupamiento de GLUT y la captación de glucosa.