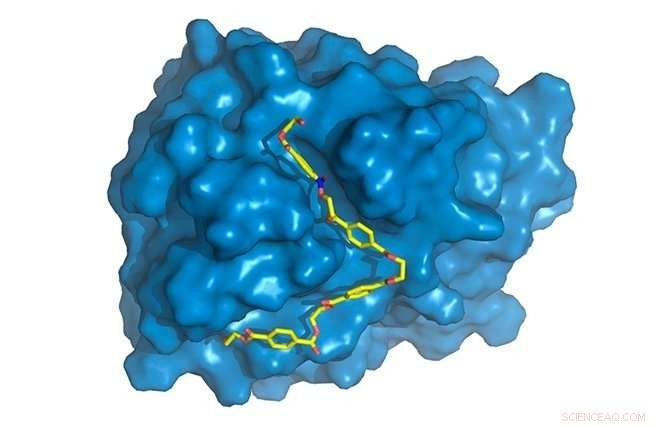
PETase se muestra en azul, con cadena de PET (amarilla) unida al sitio activo, donde se degradará. Crédito:Rodrigo Leandro Silveira
Desde que fue descubierto, la enzima conocida como PETasa ha suscitado un gran interés científico por su capacidad de digerir PET (polietilen tereftalato).
Un polímero utilizado principalmente para fabricar botellas de bebidas (pero también para ropa, alfombras, y otros productos), El PET tiene el inconveniente de la resistencia a la degradación. Las botellas y otros objetos hechos de PET (tereftalato de polietileno) tardan al menos 800 años en biodegradarse en los vertederos o en el mar. Cada año se vierten en los océanos entre 4,8 mil millones y 12,7 mil millones de kilogramos de plástico.
Un estudio con resultados publicados recientemente en la revista procedimientos de la Academia Nacional de Ciencias ( PNAS ) mostró cómo un equipo internacional de colaboradores logró impulsar la capacidad de PETase para descomponer el plástico.
"En nuestro proyecto de investigación, caracterizamos la estructura tridimensional de la enzima que puede digerir este plástico, lo diseñó para aumentar su capacidad de degradación, y demostró que también actúa sobre el polietileno-2, 5-furandicarboxilato (PEF), un sustituto del PET elaborado a partir de materias primas renovables, "dijo el coautor Rodrigo Leandro Silveira, becario postdoctoral en el Instituto de Química de la Universidad de Campinas (IQ-UNICAMP).
Una bacteria que sobrevive al metabolizar el PET
El interés en PETase surgió en 2016, cuando un grupo de investigadores japoneses dirigido por Shosuke Yoshida identificó una nueva especie de bacteria, Ideonella sakaiensis, que puede alimentarse de PET utilizándolo como fuente de carbono y energía. La bacteria sigue siendo el único organismo conocido con esta capacidad. Crece literalmente en PET.
"Además de identificar I. sakaiensis, los científicos japoneses descubrieron que produce dos enzimas y las secreta al medio ambiente, "Explicó Silveira." Una de las enzimas secretadas es la PETasa. Porque tiene un cierto grado de cristalinidad, El PET es un polímero muy difícil de degradar. Pero PETase lo ataca y lo descompone en pequeñas unidades de ácido mono (2-hidroxietil) tereftálico, o MHET. Las unidades de MHET se convierten luego en ácido tereftálico y la bacteria las absorbe y metaboliza ".
I. Sakaiensis es el único organismo vivo conocido que utiliza una molécula sintética fabricada por humanos para sobrevivir. Esto significa que la bacteria es el resultado de un proceso evolutivo muy reciente que se ha desarrollado durante las últimas décadas. La bacteria se ha adaptado a un polímero que se desarrolló a principios de la década de 1940 y solo comenzó a usarse a escala industrial en la década de 1970. PETase es la clave para entender cómo.
"PETase hace la parte más difícil, que está rompiendo la estructura cristalina y despolimerizando PET en MHET, ", dijo el investigador financiado por la FAPESP." El trabajo realizado por la segunda enzima, que convierte el MHET en ácido tereftálico, es mucho más simple, porque su sustrato consiste en monómeros a los que la enzima puede acceder fácilmente porque están dispersos en el medio de reacción. Por esta razón, la investigación se ha centrado en la PETasa ".
La enzima modificada se une mejor al polímero
El siguiente paso fue estudiar PETasa en detalle, la contribución del nuevo proyecto de investigación. "Nos enfocamos en descubrir qué le da a la PETasa la capacidad de hacer algo que otras enzimas no pueden hacer de manera muy eficiente. Comenzamos caracterizando la estructura tridimensional de esta proteína, "Explicó Silveira.
"Obtener la estructura 3-D significa descubrir la x, Coordenadas yyz de cada uno de los miles de átomos que componen la macromolécula. Nuestros colegas británicos hicieron esto utilizando una técnica conocida y ampliamente utilizada llamada difracción de rayos X disponible en un laboratorio muy similar a Sirius. ahora en construcción en Campinas ".
Una vez que obtuvieron la estructura 3-D, los investigadores comenzaron a comparar PETasa con proteínas relacionadas. El pariente más cercano es una cutinasa de la bacteria Thermobifida fusca que degrada la cutina, una especie de barniz natural que se encuentra en las hojas de las plantas. Ciertos microorganismos patógenos usan cutinasa para romper la barrera de la cutina y los nutrientes apropiados en las hojas.
"Encontramos algunas diferencias específicas en la PETasa en comparación con la cutinasa en la región de la enzima donde ocurren las reacciones químicas, conocido como el sitio activo. PETase tiene un sitio activo más abierto, por ejemplo, ", Dijo Silveira." Estudiamos los movimientos moleculares de la enzima a través de simulaciones por computadora, la parte a la que más contribuí. Mientras que la estructura cristalina, obtenido por difracción de rayos X, proporcionó información estática, las simulaciones nos proporcionaron información dinámica y nos permitieron descubrir el papel específico de cada aminoácido en el proceso de degradación del PET ".
La física de los movimientos de las moléculas resulta de la atracción y repulsión electrostática de un gran número de átomos y de la temperatura. Las simulaciones por computadora permitieron a los investigadores comprender más completamente cómo PETase se une e interactúa con PET.
"Descubrimos que PETasa y cutinasa tienen dos aminoácidos diferentes en el sitio activo. Luego usamos procedimientos de biología molecular para producir mutaciones en PETasa con el objetivo de convertirla en cutinasa, "Dijo Silveira.
"Si pudiéramos hacer eso, Descubriríamos qué componentes le daban esta propiedad única de degradar el PET. Sin embargo, para nuestra sorpresa, cuando intentamos suprimir esta actividad particular de la PETasa, al tratar de convertir la PETasa en cutinasa, producimos una PETasa aún más activa. Intentamos reducir su actividad, y, en cambio, lo potenciamos ".
Se necesitaron más simulaciones por computadora para comprender por qué la PETasa mutante era mejor que la PETasa original. El modelado y las simulaciones mostraron claramente que las alteraciones producidas en la PETasa original facilitaron la unión de la enzima al sustrato. Esta unión depende tanto de la geometría, con dos moléculas encajando juntas como llave y ojo de cerradura, y sobre los factores termodinámicos implicados en las interacciones entre los diversos componentes de la enzima y el polímero. La forma elegante de describir esto es que la PETasa modificada tiene "mayor afinidad" por el sustrato.
En cuanto a la obtención de una enzima que pueda digerir toneladas de residuos plásticos, el estudio fue un gran éxito, pero por qué PETase es PETase sigue siendo un misterio.