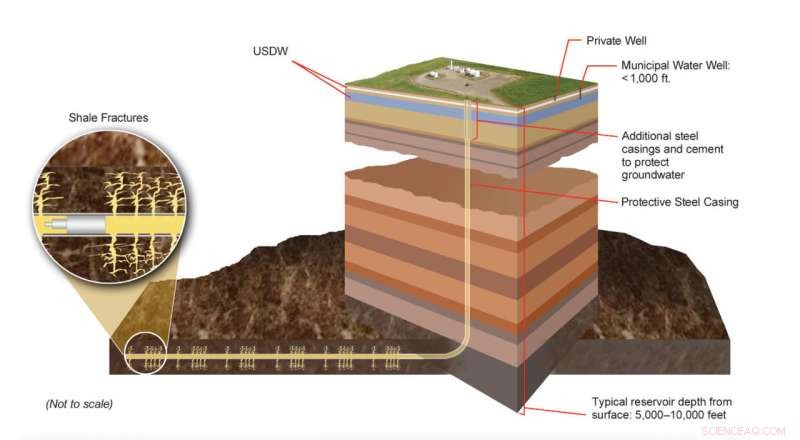
Las porciones producibles de las formaciones de gas de esquisto se encuentran a muchos miles de pies por debajo de la superficie de la tierra, muy por debajo de las fuentes subterráneas de agua potable (USDW). La tecnología moderna de fracturamiento hidráulico implica sofisticados procesos de ingeniería diseñados para crear distintas redes de fracturas en capas de roca específicas. Los expertos monitorean continuamente estos procesos para asegurarse de que cumplan con las estado, y leyes y reglamentos federales. Crédito:DOE de EE. UU.
¿Qué pasaría si se pudiera consumir un importante gas de efecto invernadero que atrapa el calor para producir una sustancia química valiosa que escasea? Los químicos del Laboratorio Nacional Brookhaven del Departamento de Energía de EE. UU. (DOE) han identificado un catalizador, una sustancia que acelera una reacción química, que puede ser capaz de hacer precisamente eso. Este catalizador "bimetálico", hecho de hierro y níquel, impulsa la reacción del gas de efecto invernadero dióxido de carbono y el gas propano rico en energía para producir propileno. El propileno es un componente químico que se utiliza en la fabricación de muchos artículos de uso diario. incluidas las baterías, Partes de automóvil, y prendas de vestir y otros textiles.
La brecha de producción de propileno
Históricamente, El propileno ha sido un subproducto del craqueo con vapor, un proceso en el que una materia prima (materia prima) se mezcla con vapor y se calienta a aproximadamente 1500 grados Fahrenheit dentro de hornos masivos que "rompen" los enlaces moleculares, para producir etileno, el precursor de la mayoría de los plásticos del mundo. Sin embargo, El propileno ya no se coproduce en las cantidades necesarias para satisfacer la demanda. En la última década, gas de esquisto, o gas natural de rocas sedimentarias de grano fino, se ha vuelto muy económico en los Estados Unidos debido a los avances tecnológicos en el fracking. El gas de esquisto se compone principalmente de metano, pero también contiene fracciones de etano y propano. La industria ha aprovechado esta abundancia de etano de bajo costo en materias primas para la producción de etileno, pero a costa de la producción de propileno.
"La cantidad de propileno coproducido depende del tipo de materia prima utilizada, y el craqueo al vapor de etano es altamente selectivo hacia el etileno, "dijo Jingguang Chen, quien tiene nombramientos conjuntos como químico senior en Brookhaven Lab y como profesor Thayer Lindsley de Ingeniería Química en la Universidad de Columbia. "Se necesitan tecnologías que se dirijan específicamente a la producción de propileno para llenar el vacío de esta importante sustancia química".
Una de las tecnologías existentes es la deshidrogenación de propano, en el que se eliminan dos átomos de hidrógeno del propano (C3H8) para producir propileno (C3H6). Pero este proceso consume mucha energía debido a las altas temperaturas requeridas para obtener rendimientos sustanciales de propileno. Aunque agregar oxígeno a la alimentación de propano reduce la cantidad de energía requerida, en presencia de exceso de oxígeno, el propano se quema para formar agua y dióxido de carbono.
Una nueva ruta para la producción de propileno
En este estudio, los científicos encontraron un enfoque más respetuoso con el medio ambiente y la energía al introducir dióxido de carbono como reactivo, en lugar de un producto.
"El dióxido de carbono actúa como oxidante, reaccionando con propano para producir propileno, agua, y monóxido de carbono, "dijo Elaine Gomez, un doctorado candidato a ingeniería química en la Universidad de Columbia y miembro del grupo de investigación de Chen. Gomez es el primer autor de un libro publicado recientemente. Comunicaciones de la naturaleza artículo que describe el trabajo.
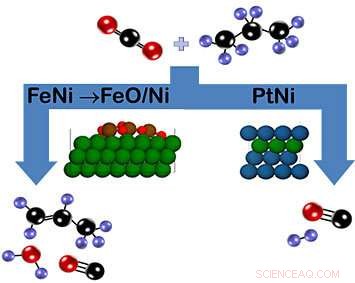
Como se muestra en el esquema, El dióxido de carbono y el propano pueden reaccionar en el catalizador de hierro-níquel (FeNi) para formar propileno (izquierda) o en el catalizador de platino-níquel (PtNi) para formar gas de síntesis (derecha). En el caso de FeNi, una capa de óxido de FeO / Ni que se forma durante la reacción favorece la rotura del enlace C-H. Por el contrario, el catalizador de PtNi no tiene fase de óxido. Clave de color:carbón =negro, oxígeno =rojo, hidrógeno =púrpura, níquel =verde, hierro =marrón, platino =azul). Crédito:Laboratorio Nacional Brookhaven
Para que esta reacción continúe, los científicos tuvieron que diseñar un catalizador que pudiera realizar dos funciones:activar el dióxido de carbono (una molécula muy estable) y romper un enlace carbono-hidrógeno (C-H).
"La base de nuestro catalizador es ceria, u óxido de cerio, que activa el dióxido de carbono intercambiando oxígeno libremente, "explicó Gómez." Además de ese apoyo, agregamos los metales hierro y níquel, que puede romper el enlace C-H ".
Sobre la base del trabajo anterior realizado por el grupo de Chen, el equipo tuvo una corazonada sobre qué catalizador elegir. Usando recursos computacionales en el Centro de Nanomateriales Funcionales de Brookhaven Lab y el Centro Nacional de Computación Científica de Investigación de Energía de Lawrence Berkeley (ambos Instalaciones para Usuarios de la Oficina de Ciencias del DOE), El químico de Brookhaven Ping Liu y el investigador asociado Shyam Kattel calcularon la cantidad de energía requerida para que se desarrollen los diferentes pasos de la reacción catalítica. Sus cálculos se basaron en estudios de espectroscopia de absorción de rayos X que Gomez y los coautores Bingham Yan y Siyu Yao del Departamento de Química de Brookhaven realizaron en Stanford Synchrotron Radiation Lightsource en SLAC National Accelerator Laboratory y Advanced Photon Source en Argonne National Lab (también DOE Instalaciones de usuarios de la Oficina de Ciencias) para identificar la estructura y composición de los sitios activos del catalizador en condiciones de reacción. Los espectros resultantes revelaron que la superficie del catalizador de hierro-níquel se oxida durante la reacción, y los cálculos mostraron que esta interfase óxido de hierro-níquel favorece la ruptura del enlace C-H.
"Un método computacional llamado teoría funcional de la densidad [DFT] nos permite calcular la termodinámica y la cinética de la vía de reacción con un catalizador dado para determinar si la ruptura del enlace C-H es energéticamente favorable, ", dijo Kattel." DFT predice que el catalizador a base de hierro y níquel es un buen candidato ".
Gómez confirmó esta predicción a través de estudios de reactores de flujo, en el que los diferentes gases reactivos se alimentan desde tanques de almacenamiento a una sola línea que se conecta a un reactor de tubo de vidrio en forma de U. La mezcla de gases fluye por un extremo del tubo y reacciona con el catalizador en polvo (a la temperatura en que el catalizador está activo; en este caso, alrededor de 1000 grados Fahrenheit) empaquetados en el otro extremo del tubo. A medida que surgen los productos, Se puede utilizar una técnica de separación llamada cromatografía de gases para identificar el tipo y las cantidades de sustancias químicas presentes. Comparando las cantidades de reactivos consumidos y los productos elaborados, los científicos pueden determinar la selectividad del catalizador hacia el producto deseado. En este experimento, la selectividad fue superior al 50 por ciento para convertir propano en propileno.
Usando el mismo soporte de ceria pero reemplazando el hierro con platino, Los científicos promovieron una vía de reacción diferente en la que los enlaces carbono-carbono se rompen para producir monóxido de carbono e hidrógeno, una combinación conocida como gas de síntesis (gas de síntesis). un intermedio para la producción de amoniaco, metanol, y otros productos químicos.
"Ambos catalizadores están activos a la misma temperatura, pero al ajustar su composición química, podemos dirigir la reacción para producir propileno o gas de síntesis, "dijo Chen.
"Planeamos utilizar nuestro conocimiento profundo actual del mecanismo de reacción para mejorar aún más la conversión de propano en propileno, ", dijo Liu." Esta comprensión permite la selección racional de catalizadores a un nivel teórico, y los candidatos prometedores serán sintetizados y probados experimentalmente ".
"Esperamos que la industria y el mundo académico consideren nuestra nueva ruta, que consume un gas de efecto invernadero y requiere menos energía que los métodos tradicionales de producción de propileno, ", dijo Gómez." Traducir nuestro descubrimiento en una tecnología comercializada podría ayudar a satisfacer la demanda mundial de este químico de alto valor ".