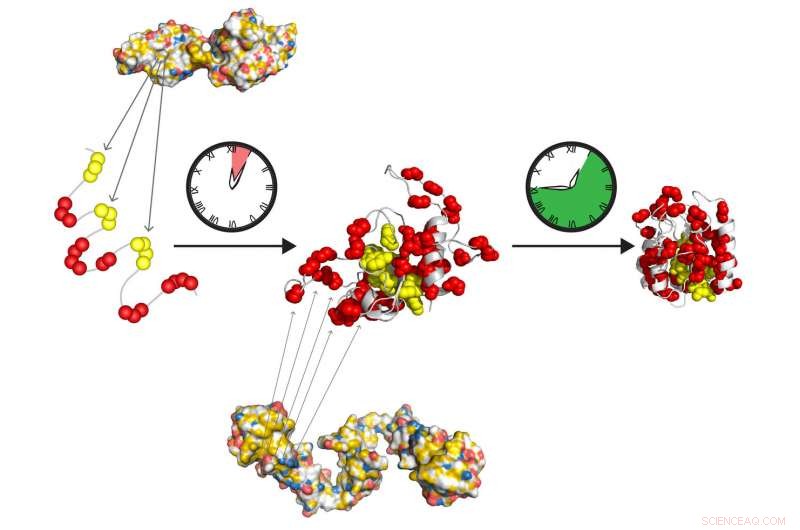
Las chaperonas moleculares Hsp70 y Hsp90 forman un equipo de relevo de acción rápida para preparar proteínas para plegarse a su estado activo por sí mismas. Hsp70 reconoce tramos hidrofóbicos cortos (amarillo), expuesto en la proteína desplegada. Hsp90 actúa aguas abajo de Hsp70 y facilita la formación del intermedio de plegado, que poco a poco se convierte en el estado nativo, libre de acciones adicionales de chaperón. Crédito:Tania Morán Luengo y Stefan Rüdiger, Universidad de Utrecht
Las proteínas celulares se producen como largas cadenas de aminoácidos que deben plegarse con precisión en su forma final. Los actores clave en este proceso de plegado son los llamados chaperones moleculares, ayudantes de proteínas que aseguran que este proceso sea exitoso. Investigadores de la Universidad de Utrecht, en estrecha colaboración con colegas de la Universidad de Heidelberg, por fin han descubierto cómo las dos familias acompañantes más importantes, Hsp70 y Hsp90, cooperar en este proceso de plegado. Asombrosamente, resulta que no ayudan activamente en el plegado, como los científicos habían asumido durante mucho tiempo. En lugar de, simplemente preparan las proteínas para espontáneas, plegado productivo. Este avance en la comprensión del funcionamiento de la cascada Hsp70-Hsp90 se publicará en Célula molecular el 3 de mayo.
Las proteínas plegadas incorrectamente pueden provocar enfermedades graves como la fibrosis quística y muchas enfermedades neurodegenerativas como el Alzheimer. Los científicos saben desde hace mucho tiempo que Hsp70 y Hsp90 juegan un papel clave en este proceso de plegado, y que Hsp90 actúa aguas abajo de Hsp70. Sin embargo, el mecanismo real por el cual pliegan una proteína sigue siendo enigmático.
Doctor. La candidata Tania Morán Luengo de la Universidad de Utrecht ha demostrado recientemente que la chaperona Hsp70 se une a la proteína joven, protegiéndolo al mismo tiempo que evita que se doble. Entonces Hsp90 rompe el bloque Hsp70, lo que permite que la proteína continúe plegándose hasta el estado correcto por sí misma. Este descubrimiento marcó el sorprendente final de la antigua creencia de que las chaperonas pliegan las proteínas.
El líder de la investigación, el Dr. Stefan Rüdiger de la Universidad de Utrecht, vislumbró esta novedosa idea mientras se preparaba para impartir un curso sobre el tema. Hsp70 se une a aminoácidos hidrofóbicos, protegiéndolas para que no se peguen entre sí hasta que se oculten dentro de la estructura final de la proteína. Se dio cuenta de que la forma en que Hsp70 se une a sus sustratos, por lo tanto, no podría contribuir al plegamiento de proteínas, sino que lo inhibe.
Luego, los investigadores se dispusieron a analizar el proceso de plegado, observando que concentraciones de Hsp70 en el rango de las presentes en nuestras células inhibían el plegamiento de proteínas. "Esto infirió que Hsp70 no es un promotor, pero de hecho un inhibidor eficaz del proceso de plegado, "Rüdiger explica. Su grupo se asoció con el laboratorio del profesor Matthias Mayer en la Universidad de Heidelberg para probar esta hipótesis de forma experimental. Demostraron que la presencia de Hsp90 en este punto es fundamental para que se produzca el proceso de plegado. Hsp90 permite que la proteína se rompa fuera del punto muerto Hsp70 para plegarse en su forma correcta por sí solo.
Molecular Cell elige una ilustración de esta investigación para su portada. La obra de arte fue realizada por el líder de investigación Stefan Rüdiger (acrílico sobre lienzo). Representa que las chaperonas conservadas Hsp70 y Hsp90 forman una cascada que solo está activa en la primera, minutos al rojo vivo del proceso de plegado. El paso posterior a través del sendero hasta el estado nativo es largo y lento, y libre de interferencias de acompañantes. Crédito:Molecular Cell / Stefan Rüdiger, Universidad de Utrecht
"Este mecanismo de parada y arranque se conserva de las bacterias al hombre, "Dice Rüdiger." Muchas enfermedades dependen de la forma activa final de las proteínas. Por lo tanto, los investigadores que trabajan en terapias que se dirigen al proceso de plegado finalmente saben qué buscar ".