Crédito:Universidad de Leiden
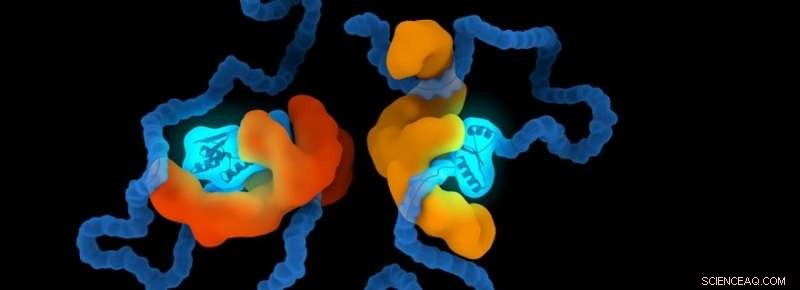
Las chaperonas son un conjunto de proteínas especializadas para ayudar a las proteínas en el cuerpo humano. Ayudan a las proteínas a plegarse a la forma correcta y las protegen de adaptarse a formas incorrectas. El grupo de investigación de Alireza Mashaghi, profesor asistente e investigador principal en LACDR, investiga estas estructuras. Vahid Satarifard, Estudiante de posgrado en el grupo de investigación:"Se han identificado más de cincuenta enfermedades asociadas con el plegamiento incorrecto de proteínas. Muchas de ellas son muy devastadoras y cada vez más prevalentes". En enfermedades proteopáticas, las proteínas pueden plegarse de forma incorrecta, volviéndose estructuralmente anormal. Esto hace que se vuelvan tóxicos o pierdan su función normal.
No se comprende bien cómo las chaperonas ayudan a otras moléculas. Se ha sugerido que las chaperonas se unen a proteínas y esto guía su plegamiento. Mashaghi:"Se sabe que los acompañantes imponen una restricción a las proteínas de sus clientes, pero si esas restricciones tienen implicaciones para el plegamiento de proteínas es una pregunta abierta. Algunos chaperones hacen contacto con los polipéptidos de sus clientes y los confinan internamente; otros abrazan a sus clientes y los confinan externamente. Demostramos que estos confinamientos pueden afectar el proceso de plegado. Ciertas formas están menos ocupadas mientras que otras se forman con mayor probabilidad. Identificamos reglas que gobiernan este proceso ". Estas reglas muestran la probabilidad de que una proteína adopte una determinada forma bajo una restricción determinada.
Tratar con formas
Mashaghi:"Preguntamos si podemos definir la topología de una molécula lineal como una proteína o ADN. La topología se ocupa de las formas. Una idea central en este campo es que si se toma un objeto y se deforma continuamente, las características topológicas no cambian, pero la deformación discontinua, como la rotura de un objeto, cambia su topología ".
Mashaghi tiene experiencia en biofísica. "Tirar de dos extremos de varias proteínas y piezas de ADN es muy parecido a tirar de una cuerda. En el caso de las cuerdas, La teoría de nudos sirve como marco estándar para definir formas. Lo que nosotros y otros investigadores nos dimos cuenta fue que más del 97 por ciento de nuestras proteínas no forman un nudo cuando se tira de ellas y, por lo tanto, caen en una clase de forma, es decir, el 'desanudo. "Nos preguntamos si podríamos definir la topología de este 97 por ciento de las proteínas y, por lo tanto, ser capaces de clasificarlas en función de sus formas".
Primero, el equipo de investigación simuló una cadena de polímero confinada dentro de una esfera. Luego, investigaron cómo esta restricción puede afectar la estructura. Satarifard:"En este estudio utilizamos modelos de polímeros bien establecidos con un nuevo marco, centrándose en la forma más que en el tamaño y las distancias. Este marco puede ofrecer una visión novedosa de la estructura basada en la disposición de los contactos. Suponemos que en los biopolímeros existen circuitos similares, que sería bastante flexible en algunas condiciones ".
Simulando una biomolécula
El equipo de investigación también comparó las formas de una cadena sin restricciones con las que está restringida externa o internamente por otra molécula. Maziar Heidari, uno de los estudiantes de posgrado, afirma:"Esto es importante en biología porque la funcionalidad de una biomolécula está determinada en gran medida por su forma. Por ejemplo, la forma en que una proteína se pliega y oculta sus sitios de unión puede afectar sus funcionalidades e interacciones con las otras proteínas ".
El equipo de investigación observó que la forma interna y la organización del plegado cambian sustancialmente a medida que la cadena se somete a diferentes niveles de confinamiento. Heidari:"Esto es interesante porque arroja luz sobre la funcionalidad y la dinámica de los posibles mecanismos y vías a través de las cuales una molécula externa, como una chaperona, se pliega y confina sus moléculas cliente. Además, nuestros resultados no se limitan al estudio de las moléculas biológicas existentes. Nuestros hallazgos pueden inspirar a otros científicos a diseñar una molécula artificial o un fármaco que se dirija a los procesos de plegamiento de proteínas o genomas ".