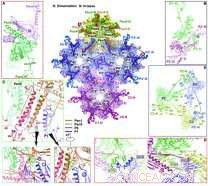
Descripción general de las interacciones en la superficie de la cápside interna. Crédito:WANG Xiangxi
El virus del herpes es genética y estructuralmente uno de los virus más complejos. Se propaga dentro de la población de acogida de manera eficiente, causando una variedad de enfermedades en humanos, incluidos los trastornos congénitos y los cánceres.
La vía de ensamblaje del herpesvirus produce tres tipos distintos de cápsides llamadas A-, Cápsides B y C, respectivamente. Los tres tipos de cápside tienen todos conchas angulares maduras y un mecanismo de ensamblaje similar. Sin embargo, se sabe poco sobre la estructura y el mecanismo de ensamblaje de la cápside del virus del herpes simple (VHS).
Usando una combinación de reconstrucción "basada en bloques" y correcciones precisas de la esfera de Ewald, Prof. WANG Xiangxi, Prof. RAO Zihe y Prof. ZHANG Xinzheng en el Instituto de Biofísica de la Academia de Ciencias de China, junto con compañeros de trabajo de la Universidad Normal de Hunan, y los Institutos Nacionales para el Control de Alimentos y Medicamentos, reconstruyó la estructura de 3,1 Å de la cápside B del virus del herpes simple tipo 2 (HSV-2) y construyó el modelo atómico, expandiendo así la comprensión del mecanismo de ensamblaje de la cápside. Este estudio fue publicado en Ciencias .
Como una de las cuatro capas estructurales principales, La cápside de 125 nm del herpesvirus no solo protege el genoma viral de daños mecánicos y de otro tipo, pero también funciona para liberar el genoma viral en el núcleo de la célula huésped durante la infección inicial y para empaquetar el genoma durante la maduración.
Los investigadores encontraron que hay cuatro confórmeros principales de la proteína principal de la cápside VP5, que exhibe notables diferencias en configuración y modo de ensamblaje para formar extensas redes intermoleculares.
El triplex, un ensamblaje heterotrimérico que encaja entre hexámeros y pentámeros en posiciones casi triples para unir la cápside, consta de dos copias de VP23, cada uno exhibiendo conformaciones notablemente diferentes, y una copia de VP19C. Seis copias de la proteína de cápside pequeña VP26 forman un anillo en la parte superior del hexón y estabilizan aún más la cápside.
Basado en la estructura de la cápside, los investigadores propusieron un modelo para el ensamblaje ordenado de la cápside utilizando un tríplex y su triángulo de lazo unido covalentemente formado por tres VP5. Estas unidades de ensamblaje básicas luego se agrupan en estructuras de orden superior que se ajustan a una simetría doble y guían a los intermedios de ensamblaje nacientes en la geometría T =16 correcta, permitiendo los primeros pasos hacia la comprensión de los impulsores del ensamblaje y la base de la estabilidad de la cápside.