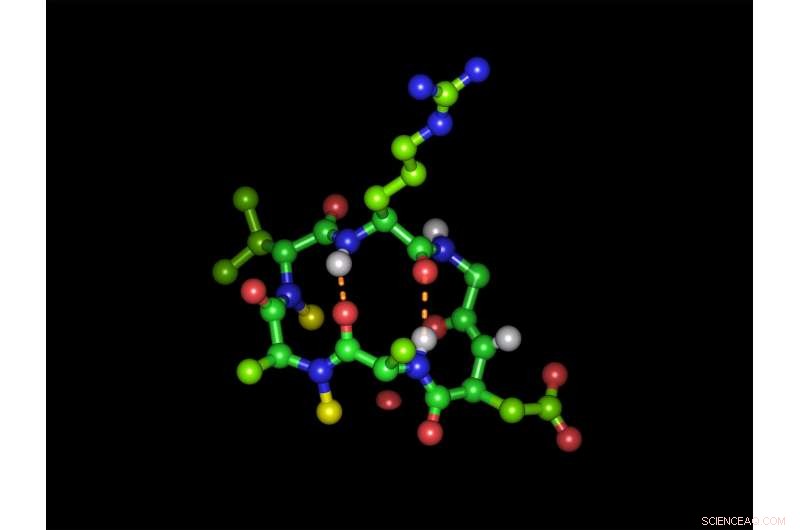
Hexapéptido cíclico en su forma bioactiva con la secuencia de tripéptido de unión a integrina arginina-glicina-ácido aspártico:las esferas verdes representan átomos de carbono, átomos rojos de oxígeno, átomos de nitrógeno azul y átomos de hidrógeno blancos. Las esferas amarillas representan los dos grupos N-metilo y las líneas naranjas discontinuas muestran los dos enlaces de hidrógeno intramoleculares. Disposición (en el sentido de las agujas del reloj):arginina (arriba), glicina ácido aspártico, Alanina Alanina N-metilada, D-valina N-metilada. Crédito:Michael Weinmueller / TUM
Péptidos cadenas cortas de aminoácidos que controlan muchas funciones en el cuerpo humano, representan un mercado de miles de millones de dólares. Pero normalmente Se deben inyectar medicamentos a base de péptidos. Un equipo de investigación dirigido por la Universidad Técnica de Múnich (TUM) ha determinado ahora cómo se pueden diseñar los péptidos para su administración en forma de líquido o tableta.
Los péptidos son cadenas cortas de aminoácidos. En el cuerpo humano controlan diversas funciones como moléculas de señalización. Los ejemplos bien conocidos incluyen insulina, que comprende bloques de construcción de 51 aminoácidos y controla el metabolismo del azúcar, o ciclosporina, un péptido de once aminoácidos que ha demostrado suprimir el rechazo de órganos después de los trasplantes.
"Los péptidos son maravillosamente adecuados como medicación, "dice Horst Kessler, Carl von Linde Profesor del Instituto de Estudios Avanzados de TU Munich. "El cuerpo ya los usa como moléculas de señalización, y cuando hayan hecho su trabajo, pueden ser reciclados por el cuerpo, sin acumulación, sin desintoxicación complicada ".
En todo el mundo, Actualmente hay unos 500 medicamentos a base de péptidos en ensayos clínicos. Un puñado de medicamentos peptídicos ya genera ingresos por miles de millones. Pero el hecho de que no puedan administrarse en forma de comprimidos es una desventaja decisiva para casi todas las sustancias de esta categoría. Dado que las proteínas son una parte importante de la dieta, el estómago y los intestinos albergan innumerables enzimas que rompen los enlaces peptídicos. Ningún medicamento basado en péptidos no modificados tendría la posibilidad de sobrevivir al paso a través del tracto gastrointestinal.
Sin embargo, incluso cuando los compuestos peptídicos adecuadamente modificados pasan intactos por el estómago, les espera otro obstáculo:las células de las paredes intestinales impiden su absorción en la sangre. Es por eso que estos tipos de agentes activos generalmente solo se administran por inyección. El equipo abordó inicialmente estos desafíos utilizando un péptido modelo en forma de anillo. Constaba de seis moléculas del aminoácido más simple, Alanina Los científicos lo utilizaron para investigar qué efecto tiene la sustitución de los átomos de hidrógeno de los enlaces peptídicos con grupos metilo sobre la disponibilidad oral.
Esto resultó en más de 50 variaciones. Las pruebas celulares realizadas por socios colaboradores en Israel mostraron que solo las variantes específicas de péptidos se absorben muy rápidamente. "Parece que los hexapéptidos cíclicos con una estructura específica pueden utilizar un sistema de transporte existente, "dice el profesor Kessler. El equipo eligió receptores de integrina que controlan una variedad de funciones en la superficie celular como un objetivo para sus péptidos. Una secuencia de los tres aminoácidos arginina, la glicina y el ácido aspártico son la clave para el acoplamiento en estos receptores. Los colaboradores de Kessler incorporaron la secuencia clave en diferentes posiciones de su péptido modelo, creando así nuevas variantes.
Sin embargo, tanto la cadena lateral cargada negativamente del ácido aspártico como la arginina cargada positivamente resultaron ser criterios de eliminación para el uso del sistema de transporte. Sin embargo, el equipo logró enmascarar los grupos cargados de ambos aminoácidos con grupos protectores. Aunque con esto el péptido inicialmente pierde su capacidad de unirse a la molécula diana, si se seleccionan los grupos protectores adecuados, se separan de nuevo por enzimas ubicuas en la sangre. El efecto farmacéutico se restablece así al llegar a su destino.

Coautores Dr. Florian Reichart, Dr. Andreas Räder, Michael Weinmueller y el Prof. Horst Kessler (fltr) en el laboratorio de la Universidad Técnica de Munich. Crédito:Uli Benz / TUM
Prueba de disponibilidad oral
Las pruebas celulares han demostrado que el nuevo hexapéptido tiene un efecto biológico. En dosis bajas estimula el crecimiento de los vasos sanguíneos. Cuando se alimenta a los ratones con el hexapéptido enmascarado, el efecto es el mismo que en aquellos a los que se les inyectó el hexapéptido desenmascarado. "En el pasado, los expertos han designado la disponibilidad oral de medicamentos basados en péptidos como el "santo grial de la química de los péptidos". Nuestro trabajo proporciona una estrategia para resolver los desafíos de estabilidad, absorción en el cuerpo y eficacia biológica, "dice Kessler." En el futuro, esto simplificará enormemente la creación de medicamentos peptídicos que se pueden administrar fácilmente en forma de líquido o tableta ".
La comunicación entre las células de un cuerpo en los distintos órganos es un requisito previo esencial para la existencia de organismos multicelulares. Receptores en la superficie celular, las llamadas integrinas, juegan un papel importante aquí. Transmiten información sobre el entorno de una célula al interior de la célula.
Tumores por ejemplo, enviar señales de crecimiento a las células de los vasos sanguíneos para que sigan creciendo y así asegurar el suministro de sangre al tumor. Además, las integrinas que funcionan mal son la causa de muchas enfermedades, lo que las hace muy interesantes para los investigadores farmacéuticos.
El papel de la secuencia de reconocimiento
De las 24 integrinas humanas, ocho subtipos reconocen una pequeña secuencia que comprende solo tres aminoácidos:arginina, glicina y ácido aspártico (abreviatura:Arg-Gly-Asp, acrónimo:RGD).
Esta estructura encaja en el receptor de la integrina como una clave. Las moléculas de señal y las proteínas que tienen esta secuencia desencadenan una reacción de la célula. Junto con otros aminoácidos que cumplen una función de reconocimiento, la estructura espacial de la secuencia determina a cuál de las integrinas encaja la clave.
Los investigadores farmacéuticos ahora están buscando moléculas que tengan estas secuencias de reconocimiento en la estructura espacial adecuada, permitiéndoles desencadenar las mismas reacciones celulares. La capacidad de dirigirse específicamente a diferentes subtipos de integrinas es un paso importante hacia la medicina personalizada en la que se pueden combatir todos los tipos de cáncer según el paciente.