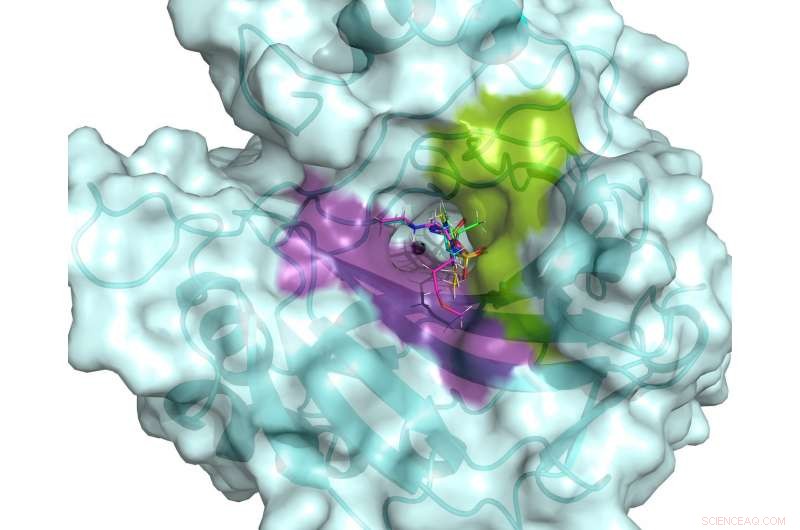
El sitio activo de hCA II. El sitio activo está flanqueado por bolsas de unión hidrófilas (violeta) e hidrófobas (verde) que se pueden utilizar para diseñar fármacos específicos dirigidos a los hCA asociados al cáncer. Se muestran cinco fármacos clínicos superpuestos en el sitio activo de hCA II, basado en estructuras de neutrones a temperatura ambiente. Crédito:ORNL / Andrey Kovalevsky
Los nuevos conocimientos del análisis de neutrones de los medicamentos para el glaucoma y su objetivo enzimático pueden ayudar a los científicos a diseñar medicamentos que se dirijan de manera más efectiva a los cánceres agresivos.
Un equipo de investigadores dirigido por el Laboratorio Nacional de Oak Ridge del Departamento de Energía utilizó cristalografía macromolecular de neutrones para investigar los diferentes estados de tres medicamentos para el glaucoma a medida que interactúan con la enzima objetivo. anhidrasa carbónica humana II (hCA II).
"Nuestro objetivo era observar diferencias en la presentación de tres fármacos para el glaucoma de uso clínico mientras están unidos a la enzima hCA II, "dijo Andrey Kovalevsky, científico de instrumentos en ORNL y coautor principal del estudio. "Al observar qué tan bien estos fármacos se dirigen a hCA II en protones, estados neutrales y desprotonados, esperábamos obtener conocimientos que hicieran posible mejorar estos medicamentos para que puedan atacar mejor las enzimas relacionadas con el cáncer ".
La protonación se refiere a la presencia, adición o pérdida de un protón, que le da a la droga un neutral, carga positiva o negativa, respectivamente. La alteración de la carga de un fármaco podría cambiar su capacidad para reconocer y unirse a su proteína objetivo y, en consecuencia, su eficacia.
El estudio, publicado en la revista Estructura , encontré esa temperatura, pH y la carga eléctrica de los tres fármacos para el glaucoma afectó su capacidad para dirigirse y unirse a la enzima hCA II.
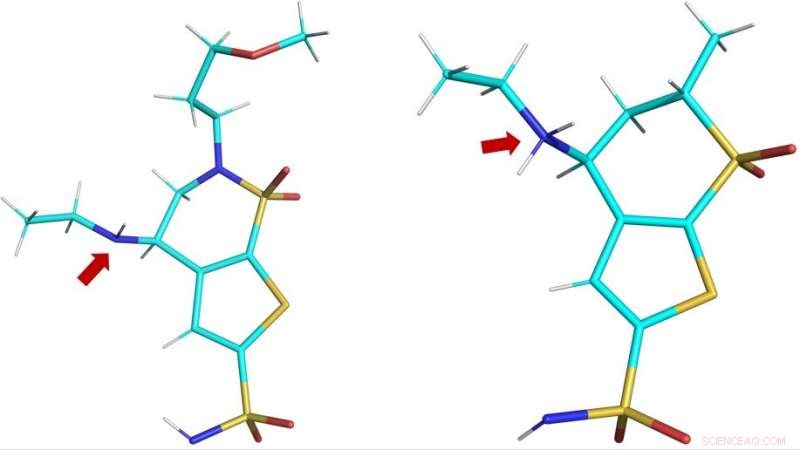
Estructuras tridimensionales de los medicamentos clínicos brinzolamida (BZM, izquierda) y dorozolamida (DZM, derecha) como se observa en el sitio activo de hCA II. La flecha roja muestra los grupos amino de las drogas:en BZM, el átomo de nitrógeno (en azul) no está protonado y, por tanto, no está cargado; en DZM, el átomo de nitrógeno ha aceptado un protón extra y, por tanto, está cargado positivamente. Crédito:ORNL / Andrey Kovalevsky
"Este descubrimiento fue realmente una prueba de principios para nosotros, "dijo Robert McKenna, profesor de la Universidad de Florida y coautor principal del estudio. "Nos abrió los ojos a cómo los cambios en la temperatura y el pH pueden afectar el estado de protonación del fármaco, lo que a su vez lo hace más o menos efectivo ".
La nueva información sobre las redes de enlaces de hidrógeno que forman el sitio activo de hCA II puede ayudar a otros científicos a desarrollar fármacos nuevos y mejores para el tratamiento del cáncer. La familia de enzimas hCA contiene proteínas similares, como hCA IX y XII, que están asociados con cánceres de mama agresivos, como el cáncer de mama triple negativo.
"Queremos aprovechar la diferencia a cargo, pH y temperatura para ver si podemos diseñar medicamentos que sean más efectivos para atacar estas enzimas, ", dijo Kovalevsky." Si podemos entender la unión a nivel atómico, podemos rediseñar medicamentos y convertirlos en "imanes" más fuertes y selectivos que serán atraídos por las enzimas asociadas al cáncer. Dichos medicamentos serían mucho más efectivos para matar las células cancerosas sin dañar las células sanas. lo que reduce significativamente los efectos secundarios para los pacientes ".
Muchos científicos han utilizado la cristalografía de rayos X para analizar las estructuras de las enzimas de hCA, pero estos estudios carecen de información atómica completa sobre la unión de fármacos debido a la incapacidad de los rayos X para visualizar átomos de hidrógeno abundantes en proteínas y enzimas.
Los neutrones son sensibles a elementos más ligeros, por lo que proporcionan información mucho más detallada sobre la ubicación de los átomos de hidrógeno. Ver el hidrógeno es fundamental para estudiar los estados de protonación de una enzima y un ligando, una molécula que se une a una macromolécula biológica, y para analizar la arquitectura de las redes de enlaces de hidrógeno. Los neutrones también ofrecen otras ventajas experimentales.
"Cuando usas la difracción de neutrones, no tienes daño por radiación, para que puedas hacer tu estudio a temperatura ambiente, "dijo McKenna." Además, Los cristales congelados pueden alterar el fármaco y la enzima. introducir una visión falsa en el estudio, mientras que los estudios de temperatura ambiente se asemejan más al entorno en el que se utilizará el fármaco ".