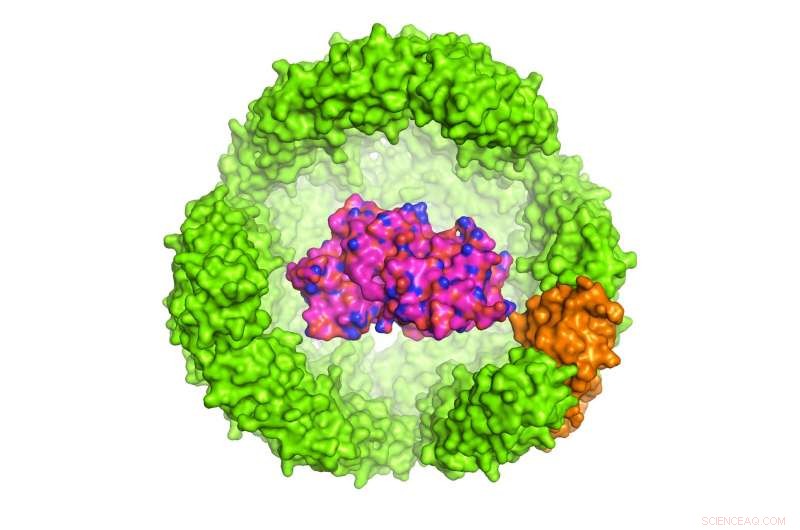
Ilustración de una proteína de interés (POI) dentro de un exoshell de ferritina de Archeoglobus fulgidus de 24 subunidades, que tiene 12 nanómetros de diámetro (solo se muestra la mitad de la capa). Crédito:Dr. Chester L. Drum
Un equipo de la Escuela de Medicina NUS Yong Loo Lin (Medicina NUS) ha inventado una forma fundamentalmente nueva de plegar y proteger proteínas recombinantes. Procedente del campo en rápida expansión de la biología sintética, esta tecnología de proteína en una proteína puede mejorar la producción de proteínas funcionales en 100 veces y proteger las proteínas recombinantes del calor, productos químicos agresivos y proteólisis.
La expresión y estabilización de proteínas recombinantes es la piedra angular de las industrias biológica y farmacéutica. Los costos y la complejidad asociados con la fabricación de proteínas recombinantes difíciles de plegar a escala industrial son un factor limitante significativo para su uso en aplicaciones clínicas e industriales.
El estudio dirigido por el Dr. Chester Drum, Profesor Adjunto de los Departamentos de Medicina y Bioquímica, NUS Medicine se publicó en la revista Comunicaciones de la naturaleza el 13 de noviembre de 2017. Drum y sus colegas diseñaron un exoshell de 12 nanómetros de diámetro y lo envolvieron alrededor de una proteína de interés (POI). Demostraron por primera vez que esta tecnología se puede usar para plegar y proteger una variedad de proteínas dentro de cavidades diseñadas que son menos de 1:10. 000 el ancho de un cabello humano.
Los investigadores desarrollaron esta tecnología de proteína dentro de una proteína con la ayuda de Archeoglobus fulgidus, una bacteria resistente que se encuentra naturalmente en los respiraderos hidrotermales. Estas bacterias hiper-termófilas han desarrollado soluciones únicas para el plegamiento y estabilización de proteínas debido a los entornos extremos en los que viven.
En particular, los investigadores hicieron uso de un portador de hierro, Proteína de 24 subunidades en A. fulgidus llamada ferritina, cuya función natural es almacenar y transportar hierro en la sangre. La ferritina de A. fulgidus tiene dos propiedades únicas:primero, cuatro poros diminutos en su caparazón permiten que las moléculas pequeñas accedan a la cavidad; segundo, a diferencia de la ferritina humana, que es estable a bajas concentraciones de sal, la ferritina de A. fulgidus modificada se disocia a bajas concentraciones de sal, permitiendo que el contenido de la cavidad sea liberado por un simple cambio de pH de 8.0 a 5.8. Una vez disociado, el POI se puede liberar enzimáticamente.
Para demostrar la amplia versatilidad de su tecnología, los investigadores probaron su tecnología exoshell fusionando una de las 24 subunidades de ferritina alrededor de tres PDI con diversas propiedades:proteína verde fluorescente, peroxidasa de rábano picante (HRP) y luciferasa de Renilla.
El exoshell no solo ayudó a aumentar el rendimiento de los tres puntos de interés, los investigadores también pudieron administrar cofactores hemo y calcio, además de condiciones oxidantes, para asegurar que los POI complejos, como la proteína HRP, puedan plegarse y funcionar correctamente.
Además de ayudar a plegar correctamente los puntos de interés, las exosconchas también protegían contra una amplia gama de desnaturalizantes, incluyendo tripsina de alta concentración; disolventes orgánicos como acetonitrilo y metanol; y desnaturalizantes como urea, ácido clorhídrico de guanidina, Y calor.
"Presumimos que el aumento significativo en el rendimiento de proteínas funcionales puede deberse a la complementación entre las proteínas cargadas negativamente y la superficie interna del exoshell cargada positivamente. Nuestros hallazgos destacan el potencial de utilizar conchas de tamaño nanométrico altamente diseñadas como una herramienta de biología sintética para drásticamente afectar la producción y estabilidad de proteínas recombinantes, "dijo Dr Drum, quien también es cardiólogo consultor en el Hospital Universitario Nacional y director del Laboratorio de Innovación de Ensayos Clínicos en TLGM, UNA ESTRELLA.
Reclutado en la Universidad Nacional de Singapur en 2011, desde entonces ha recibido financiación de la Alianza MIT de Investigación y Tecnología de Singapur, Consejo Nacional de Investigaciones Médicas, Consejo de Investigaciones Biomédicas, Medicina A * STAR y NUS.
La investigación actual del Dr. Drum cierra la brecha entre la bioquímica básica y la atención clínica. Actualmente es el investigador principal en un ámbito multiinstitucional, 3, Ensayo observacional de 000 personas en Singapur que estudia cómo el metabolismo personalizado de los fármacos afecta la respuesta al fármaco.