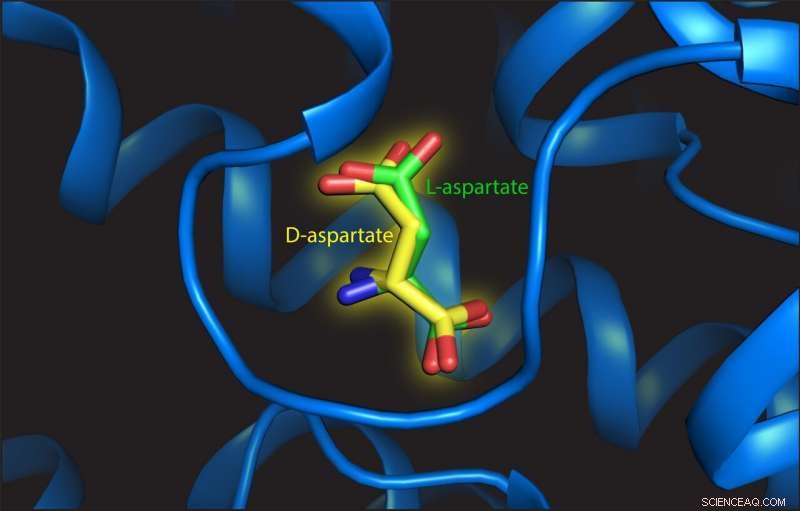
Esta ilustración muestra L- y D-aspartato en el sitio de unión de la proteína de transporte. Crédito:Valentina Arkhipova, Universidad de Groningen
Muchas biomoléculas vienen en dos versiones que son la imagen especular de la otra, como una mano derecha e izquierda. Las células generalmente usan la versión izquierda de los aminoácidos para producir proteínas, y se pensó que los mecanismos de captación compartían esta preferencia. Los científicos de la Universidad de Groningen han demostrado que una proteína de transporte procariota puede transportar ambas versiones del aminoácido aspartato con la misma eficacia. El análisis detallado de la estructura del transportador muestra por qué este es el caso. Los resultados fueron publicados en la revista eLife el 24 de abril.
La "mano izquierda" de la vida se conoce desde hace más de un siglo. Muchas moléculas orgánicas se producen en dos versiones que tienen la misma fórmula química y conectividad entre los átomos, pero son estructuralmente la imagen especular de cada uno. Durante la evolución, se ha seleccionado la versión para zurdos (L) para algunas moléculas, mientras que para otros se utiliza la imagen especular (D). Este es un problema en la fabricación de medicamentos, donde a veces solo una versión es efectiva y la otra versión puede causar efectos secundarios graves.
Contra las expectativas
"Los organismos vivos utilizan L-aminoácidos en la producción de proteínas, pero ocasionalmente usarán D-aminoácidos, por ejemplo en las paredes de las células bacterianas, ", explica el profesor de bioquímica de la Universidad de Groningen, Dirk Slotboom. El sistema nervioso central de los mamíferos tiene una proteína de transporte para el neurotransmisor L-glutamato que también puede transportar el aminoácido aspartato". Y resulta que reconoce tanto el L-aspartato como el D- aspartato ".
Esto va en contra de las expectativas. Dado que los L-aminoácidos son los compuestos funcionalmente activos, Tendría sentido para las proteínas de transporte seleccionar sólo una "mano". Slotboom:"Esto se deriva de la diferencia en la estructura. El reconocimiento por parte de un transportador requiere que la estructura de la molécula encaje en el sitio de unión". Y así como no es posible meter la mano izquierda en un guante para diestros, la unión de D-aminoácidos a una proteína de transporte que ha evolucionado para aceptar L-aminoácidos es imposible.
Afinidad
Hasta ahora no se han realizado estudios mecánicos o estructurales reales para explicar por qué el transportador del sistema nervioso central parece desafiar esta lógica. Por lo tanto, Slotboom, junto con su colega Albert Guskov, Profesor Asistente y Jefe del Laboratorio de Cristalografía de Rayos X Biomolecular, decidió abordar esta cuestión. Su investigadora postdoctoral Valentina Arkhipova llevó a cabo un análisis estructural de la proteína de transporte, mientras que Ph.D. El alumno Gianluca Trinco realizó estudios funcionales. Por sus experimentos, utilizaron la proteína de transporte homóloga que se encuentra en los microorganismos, que tiene un sitio de unión que es casi idéntico al del transportador de mamíferos.
Trinco descubrió que el L-aspartato y el D-aspartato se transportaban de la misma manera, impulsado por la translocación de tres iones de sodio. "Además, la afinidad por ambos sustratos también es similar, ", dice. Arkhipova estudió la estructura del sitio de unión con L- o D-aspartato adjunto. Observó que el D-aspartato se acomodó con solo pequeñas reordenaciones de la estructura:" La clave es que hay suficiente espacio para los elementos geométricos D-aspartato diferente para unir. El sitio de unión no es como un guante, pero más como una manopla ".
Neurotransmisor
En microorganismos, la proteína solo transporta aspartato, que las células podrían utilizar para construir proteínas y también como combustible o como fuente de nitrógeno. En mamíferos, la proteína homóloga transporta glutamato en el sistema nervioso central, donde el aminoácido se utiliza como neurotransmisor. La proteína de transporte elimina el L-glutamato de la hendidura sináptica, la parte donde un impulso nervioso se transmite a otra neurona.
Hay indicios de que el aspartato también puede actuar como neurotransmisor. "Si ese fuera el caso, tanto el L- como el D-aspartato pueden realizar esta función, "dice Slotboom." La afinidad por ambos tipos de aspartato es muy alta. Esto puede apuntar a una función específica y sugiere que el D-aspartato también se usa para algo ". El transportador no acepta el D-glutamato. De nuevo, esto parece ser una cuestión de espacio:el glutamato tiene un grupo metileno adicional en comparación con el aspartato. "Y en D-glutamato, que el metileno probablemente causa un choque con el sitio de unión. "No encaja, ni siquiera en una manopla.