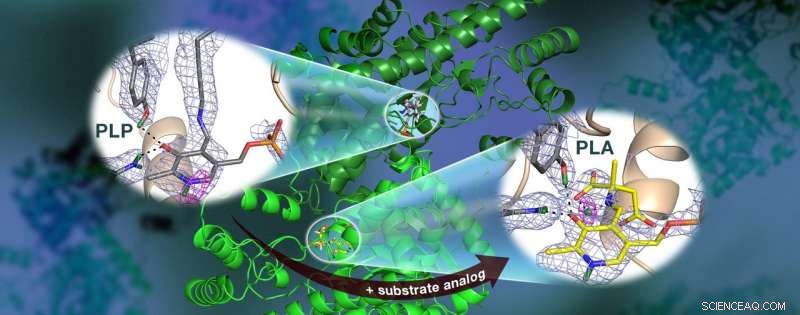
Un equipo dirigido por ORNL utilizó neutrones para observar la enzima AAT, una proteína dependiente de la vitamina B6, y encontró que la reacción química ocurrió solo en un sitio activo. Los mapas de densidad de longitud de dispersión nuclear (malla de colores) resaltan las posiciones de los átomos de hidrógeno críticos, incluyendo un enlace de hidrógeno de barrera baja (malla magenta) que no se cree que exista en AAT, que puede ser crucial para la catálisis. Crédito:Jill Hemman y Andrey Kovalevsky / Laboratorio Nacional Oak Ridge, Departamento de Energía de EE. UU.
Los científicos del Laboratorio Nacional de Oak Ridge del Departamento de Energía han realizado un análisis estructural de neutrones de una proteína dependiente de la vitamina B6, potencialmente abriendo vías para nuevos antibióticos y medicamentos para combatir enfermedades como la tuberculosis resistente a los medicamentos, malaria y diabetes.
Específicamente, el equipo utilizó cristalografía de neutrones para estudiar la ubicación de los átomos de hidrógeno en la aspartato aminotransferasa, o AAT, una enzima vital para el metabolismo de ciertos aminoácidos.
"Visualizamos la primera estructura de neutrones de una enzima de vitamina B6 que pertenece a una gran familia de proteínas con cientos de miembros que existen en la naturaleza, "dijo Andrey Kovalevsky de ORNL, un coautor principal del estudio, que fue publicado en Nature Communications.
Las proteínas dependientes de la vitamina B6 son parte de un grupo diverso de enzimas que llevan a cabo más de cien reacciones químicas diferentes en las células. Las enzimas son de interés biomédico, así como bioenergía, investigadores debido a su papel en la metabolización de aminoácidos y otros nutrientes celulares.
"Estas enzimas son únicas en el sentido de que cada una realiza una reacción química específica con una precisión exquisita, mientras se suprimen otras transformaciones químicas viables, "Dijo Kovalevsky." No se comprende bien cómo logran esto, pero es de gran importancia para el diseño de fármacos ".
La investigación anterior del equipo predijo que los átomos de hidrógeno se mueven dentro y alrededor del sitio activo de la enzima, donde tiene lugar la reacción química, lo que indica que la posición de los átomos de hidrógeno controla el tipo de reacción. Conocer la ubicación precisa de los átomos de hidrógeno puede explicar por qué el comportamiento de estas enzimas es tan específico, pero el hidrógeno es difícil de detectar con métodos estándar como la cristalografía de rayos X.
Para determinar directamente las posiciones de los átomos de hidrógeno dentro de AAT, el equipo dirigido por ORNL se centró en las técnicas de difracción de neutrones. Los investigadores expusieron delicados cristales de proteína a neutrones utilizando la línea de luz IMAGINE en el reactor de isótopos de alto flujo de ORNL y la línea de luz LADI-III en el Institut Laue-Langevin en Grenoble. Francia.
Asombrosamente, el equipo observó una reacción dentro de una biomolécula de proteína AAT mientras que otra biomolécula de AAT no se modificó, proporcionando una perspectiva de antes y después de la reacción química catalizada por enzimas.

Steven Dajnowicz de ORNL (izquierda) y Andrey Kovalevsky prepararon una muestra para comenzar el análisis estructural de neutrones de una proteína dependiente de vitamina B6 utilizando la línea de luz IMAGINE en el reactor de isótopos de alto flujo de ORNL. Los resultados del estudio podrían abrir caminos para nuevos antibióticos y medicamentos para combatir enfermedades. Crédito:Genevieve Martin / Laboratorio Nacional Oak Ridge, Departamento de Energía de EE. UU.
"Los datos revelaron que en una de las estructuras biomoleculares de la enzima, los enlaces covalentes se reorganizaron después de que ocurriera una reacción química en el sitio activo y, en otro, la reacción no se había producido, "Dijo Kovalevsky." Esencialmente, pudimos obtener dos estructuras en un cristal, lo que nunca se ha hecho antes para ninguna proteína que utilice neutrones ".
Con este conocimiento, el equipo ejecutará simulaciones moleculares para determinar el comportamiento específico de los átomos de hidrógeno al interactuar con la enzima. Los resultados podrían ser útiles para orientar el diseño futuro de nuevos medicamentos contra la tuberculosis multirresistente. malaria, diabetes y bacterias resistentes a los antibióticos.
"Este estudio destaca cómo los neutrones son una sonda incomparable para identificar la ubicación de átomos de hidrógeno en sistemas biológicos, proporcionándonos un nivel de detalle estructural sin precedentes para esta importante enzima, ", Dijo el científico de la línea de luz LADI-III, Matthew Blakeley.