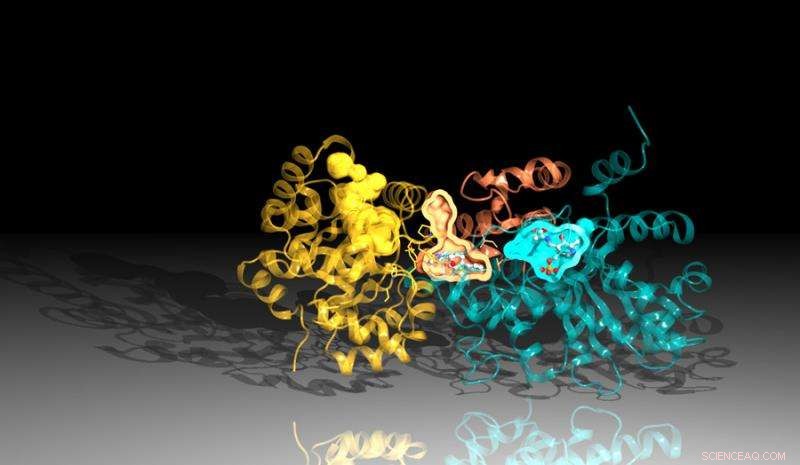
Imagen de la proteína triptófano sintasa creada utilizando datos de difracción de Advanced Photon Source de Argonne. El inhibidor se une entre los sitios de reacción en la proteína, representado aquí por los bolsillos naranja y azul. Crédito:Laboratorio Nacional Argonne
La tuberculosis ha superado al VIH en todo el mundo como la principal causa de muerte por enfermedades infecciosas. La bacteria que causa esta enfermedad, Mycobacterium tuberculosis (Mtb), está desarrollando rápidamente resistencia a los antibióticos actualmente disponibles, aumentando la urgencia por el descubrimiento de nuevos fármacos.
Los científicos del Laboratorio Nacional Argonne del Departamento de Energía de EE. UU. (DOE) fueron parte de un descubrimiento reciente de una nueva molécula llamada inhibidor que ataca a las bacterias que causan la tuberculosis al interrumpir la producción de una sustancia química necesaria para su supervivencia.
La creación de antibióticos implica el desarrollo de inhibidores que puedan bloquear eficazmente los procesos bacterianos esenciales. Igualmente importante es seguir encontrando nuevas vías a las que apuntar para que cuando las bacterias finalmente se adapten para resistir un antibiótico, todavía hay otras vías disponibles para explotar.
El nuevo estudio, una colaboración entre Argonne, la Universidad de Chicago y el Instituto Broad de Harvard y MIT, identificó un inhibidor que actúa bloqueando la acción de una proteína importante en Mtb. El inhibidor se une a un canal dentro de la proteína que conecta sus dos partes, matando a las bacterias a través de un giro irónico. El inhibidor obliga a una parte de la proteína a producir los componentes necesarios para crear una sustancia química esencial, triptófano, mientras que, al mismo tiempo, modifica el canal para interceptar esos ingredientes antes de que la otra parte de la proteína pueda usarlos.
Estos tipos de inhibidores, llamados inhibidores alostéricos, no se unen a la parte de la proteína realmente responsable de producir la sustancia química diana. En lugar de, actúan como una llave inglesa atascada en otras partes menos obvias de la complicada maquinaria de las bacterias. El inhibidor identificado en esta investigación, descrito en un artículo reciente en Nature Chemical Biology, es ahora uno de los inhibidores alostéricos más profundamente estudiados hasta la fecha.
El químico objetivo, triptófano, es una sustancia crucial para dar estructura a todas las células vivas y protegerlas de su entorno. Las células humanas tienen que hurgar en el triptófano de los alimentos o las bacterias en el intestino, pero las células Mtb pueden fabricar su propio triptófano utilizando una proteína compleja llamada triptófano sintasa. "Sabíamos que una forma de matar estas bacterias era encontrar una forma de bloquear la triptófano sintasa, "dijo Karolina Michalska, cristalógrafo de Argonne y autor del estudio.
Antes de que comenzara la colaboración, un grupo de científicos del Broad Institute colocó una pequeña cantidad de la bacteria en placas de Petri y colocó diferentes inhibidores potenciales en cada una. De una biblioteca de más de 80, 000 inhibidores potenciales probados, solo unos pocos mataron al Mtb. Los científicos sospecharon que uno de estos inhibidores apagaba la triptófano sintasa de Mtb, pero necesitaban ver lo que estaba sucediendo a nivel molecular.
Los científicos de Argonne se enteraron del trabajo en el Broad Institute, y los dos grupos empezaron a colaborar. Argonne produjo triptófano sintasa para que el Broad Institute lo usara para probar el inhibidor. También determinaron la estructura de la sintasa con el inhibidor unido a ella exponiendo cristales compuestos por el complejo proteína-inhibidor a rayos X de alta energía de la fuente de fotones avanzada de Argonne (APS) y registrando cómo los electrones en la molécula dispersaban la luz. .
"La colaboración nos permitió determinar la naturaleza alostérica del inhibidor y los matices de cómo funcionaba la inhibición, "dijo Deborah Hung, profesor de la Facultad de Medicina de Harvard y codirector del Programa de Microbioma y Enfermedades Infecciosas del Broad Institute.
El análisis estructural determinó que hay dos partes clave que componen la triptófano sintasa. Cuando una de las regiones le indica a la otra que está lista, la otra región produce una sustancia química llamada indol. El indol luego viaja a través de un canal a la otra región de la triptófano sintasa donde se combina con otra sustancia para crear el producto final. triptófano.
Una leve inestabilidad en el canal permitiría al indol viajar al otro lado, pero el inhibidor tiene una forma que estabiliza el canal, evitando que el indol se mueva. Dado que el indol no puede alcanzar el lado opuesto de la proteína, el inhibidor bloquea la producción de triptófano.
"En realidad, funciona de una manera bastante engañosa, "dijo Andrzej Joachimiak, Director del Centro de Biología Estructural de Argonne y del Centro del Medio Oeste de Genómica Estructural. "El inhibidor fuerza a la triptófano sintasa a producir el indol y le impide llevar a cabo su función final".
Aunque los investigadores son optimistas sobre el potencial de este inhibidor como antibiótico, todavía está lejos de ser un producto farmacéutico disponible. Han estudiado cómo reaccionaría el tejido humano a la molécula y han confirmado que no es tóxico. pero los experimentos en ratones han demostrado que el organismo metabolizaría el inhibidor con demasiada rapidez. Ahora se están realizando investigaciones para refinar la estructura del inhibidor para que persista en el torrente sanguíneo durante un período prolongado.