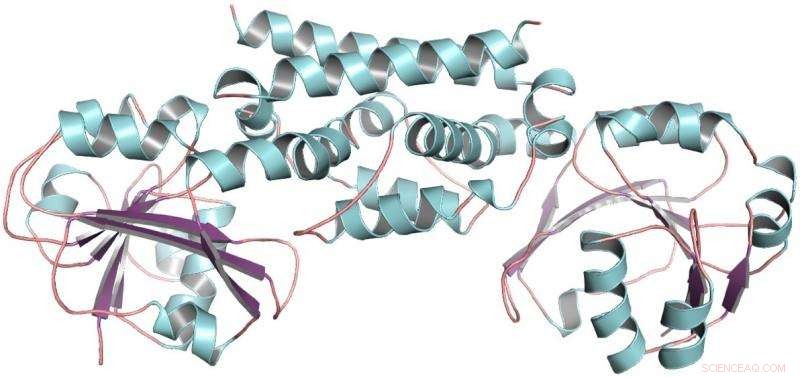
La estructura tridimensional de la enzima PDH de la soja, una legumbre. Esta estructura ayudó a demostrar que solo una mutación permitió a las leguminosas desarrollar una nueva forma de producir el aminoácido tirosina. Crédito:Craig Schenck
Mientras muerde su próximo sándwich de mantequilla de maní y mermelada, mastique esto:el maní que está comiendo tiene un secreto.
Es sutil. El maní y sus parientes, las legumbres, no tienen uno, pero dos formas de producir el aminoácido tirosina, uno de los 20 necesarios para producir todas sus proteínas, y un nutriente humano esencial. Eso puede parecer pequeño pero por qué esta familia de plantas tiene una forma única de fabricar un componente químico tan importante es un misterio que se remonta a la década de 1960 y que ha captado la atención de Hiroshi Maeda. profesor de botánica en la Universidad de Wisconsin-Madison.
"Estamos interesados en la química de las plantas, tratando de entender cómo las plantas producen tantos compuestos químicos diferentes, muchos de los cuales son importantes para nuestra sociedad humana como alimento, fibra, alimentación, combustible, medicina, tantas cosas, "dice Maeda.
Esas moléculas importantes parten de compuestos más simples, como la tirosina, que es el precursor de la morfina e innumerables otras sustancias químicas interesantes y útiles.
En una nueva investigación publicada en la edición del 26 de junio de Biología química de la naturaleza , Maeda y su estudiante de posgrado Craig Schenck, junto con colaboradores de la Universidad de Washington en St. Louis, informan cómo la familia de las leguminosas desarrolló su segunda vía de tirosina. Descubrieron la estructura de una nueva enzima vegetal, uno que podría ser una herramienta útil para los biotecnólogos que intentan controlar la producción de tirosina y sus derivados. Y vincularon un cambio evolutivo importante en el metabolismo de las plantas a una sola mutación en la nueva enzima.
En las décadas de 1960 y 1970, Los científicos estudiaron el mundo de las plantas para descubrir cómo fabricaban compuestos metabólicos clave, como los aminoácidos. Si bien todas las plantas usaban una vía, conocido como ADH, para hacer tirosina, la familia de las leguminosas:guisantes, frijoles, cacahuetes:añadido de forma única un segundo, llamado PDH, que de otro modo se encontraba sólo en microbios. Nadie sabía por qué y el problema fue dejado de lado.
Pero hace dos años Maeda y Schenck desempolvaron el viejo misterio. Cavando en descubrieron los genes responsables de la producción de tirosina. Descubrieron que las legumbres habían desarrollado sus enzimas PDH a partir de las ADH existentes, justo antes de que los cacahuetes y los guisantes se convirtieran en linajes separados. Las enzimas hermanas eran muy similares, lo que significaba que solo una pequeña cantidad de cambios podían explicar cómo las enzimas ADH evolucionaron hacia las PDH. Pero todavía había demasiados cambios para probar uno por uno para ver cuáles tenían efecto.
Entonces Maeda recibió una llamada de Joe Jez, bioquímico de la Universidad de Washington. Con Cynthia Holland, estudiante de Jez, los dos equipos colaboraron para purificar la enzima PDH de la soja, una legumbre, y determinar su estructura tridimensional. Con la estructura de PDH en la mano, Schenck pudo ver que a lo largo del tiempo evolutivo, sólo se habían producido un par de mutaciones en el lugar donde se producían las reacciones químicas. En lugar de probar decenas de mutaciones, solo tenía dos.
Schenck descubrió que al cambiar un solo aminoácido en el centro de la enzima, pudo convertir en gran medida la enzima PDH de la soja de nuevo en su enzima antecesora ADH. El interruptor funcionó para enzimas de múltiples especies, y funcionó a la inversa:Schenck podría dar enzimas ADH de plantas no leguminosas características similares a la PDH.
Maeda y Schenck habían descubierto que las legumbres evolucionaron de una manera novedosa para producir una sustancia química importante principalmente al tropezar con una sola, interruptor crucial.
"El resultado más sorprendente es que un solo residuo realmente jugó un papel importante en el cambio para producir esta enzima específica de leguminosas, ", dice Maeda." Y eso plantea una pregunta interesante de por qué otros grupos de plantas nunca desarrollaron esta enzima única. Porque solo con azar quizás esta mutación ocurrió pero nunca se mantuvo ".
Por qué las legumbres se aferraron a su nueva vía de tirosina, y qué ventaja podría proporcionar, requerirá más trabajo.
Otra comida para llevar dice Maeda, es que el mismo interruptor que convierte las enzimas ADH en PDH apaga la capacidad de la tirosina para inhibir la función de la enzima. Aunque este tipo de autorregulación suele ser útil para las células, Maeda cree que la insensibilidad de la PDH a la tirosina podría ser de gran ayuda para ayudar a producir más tirosina, y sus derivados útiles, en sistemas como levadura o plantas artificiales.
"La idea es que la adormidera, por ejemplo, produce tirosina a través de una vía estándar de ADH que probablemente es inhibida por la tirosina, "explica Schenck, quien recientemente completó su doctorado en el laboratorio de Maeda, discutir posibles aplicaciones para la nueva investigación. "Si podemos introducir una enzima que no sea inhibida por la tirosina, tal vez podamos aumentar la reserva total del precursor de tirosina para aumentar la producción de morfina. Puede ser una herramienta útil en el futuro en otras especies de plantas o incluso en microbios ".