
El postdoctorado del MIT Sulata Sahu (izquierda) y el estudiante graduado Brian Chmielowiec sostienen una muestra de cobre casi puro depositado en un electrodo de hierro. Crédito:Denis Paiste / Centro de procesamiento de materiales
Los investigadores del MIT han identificado la temperatura y la mezcla química adecuadas para separar selectivamente el cobre puro y otros oligoelementos metálicos de los minerales a base de azufre mediante electrólisis fundida. Este un paso, El proceso ecológico simplifica la producción de metales y elimina los subproductos tóxicos como el dióxido de azufre.
El postdoctorado Sulata K. Sahu y el estudiante de doctorado Brian J. Chmielowiec '12 descompusieron minerales ricos en azufre en azufre puro y extrajeron tres metales diferentes con una pureza muy alta:cobre, molibdeno, y renio. También cuantificaron la cantidad de energía necesaria para ejecutar el proceso de extracción.
Una celda de electrólisis es un circuito cerrado, como una batería, pero en lugar de producir energía eléctrica, consume energía eléctrica para descomponer los compuestos en sus elementos, por ejemplo, dividiendo el agua en hidrógeno y oxígeno. Dichos procesos electrolíticos son el método principal de producción de aluminio y se utilizan como paso final para eliminar las impurezas en la producción de cobre. Al contrario que el aluminio, sin embargo, No existen procesos directos de descomposición electrolítica para que los minerales de sulfuro que contienen cobre produzcan cobre líquido.
Los investigadores del MIT encontraron un método prometedor para formar metal de cobre líquido y gas de azufre en su celda a partir de un electrolito compuesto de sulfuro de bario. sulfuro de lantano, y sulfuro de cobre, que rinde más del 99,9 por ciento de cobre puro. Esta pureza es equivalente a los mejores métodos de producción de cobre actuales. Sus resultados se publican en un artículo de Electrochimica Acta con el autor principal Antoine Allanore, profesor asistente de metalurgia.
Proceso de un solo paso
"Es un proceso de un solo paso, directamente simplemente descomponga el sulfuro en cobre y azufre. Otros métodos anteriores son varios pasos, "Sahu explica." Al adoptar este proceso, nuestro objetivo es reducir el costo ".
El cobre tiene una demanda creciente para su uso en vehículos eléctricos, energía solar, electrónica de consumo y otros objetivos de eficiencia energética. La mayoría de los procesos de extracción de cobre actuales queman minerales de sulfuro en el aire, que produce dióxido de azufre, un contaminante del aire nocivo que debe capturarse y reprocesarse, pero el nuevo método produce azufre elemental, que se puede reutilizar de forma segura, por ejemplo, en fertilizantes. Los investigadores también utilizaron la electrólisis para producir renio y molibdeno, que se encuentran a menudo en los sulfuros de cobre en niveles muy pequeños.
El nuevo trabajo se basa en un artículo de 2016 de la Revista de la Sociedad Electroquímica que ofrece una prueba de extracción electrolítica de cobre escrito por Samira Sokhanvaran, Sang-Kwon Lee, Guillaume Lambotte, y Allanore. Demostraron que la adición de sulfuro de bario a una masa fundida de sulfuro de cobre suprimió la conductividad eléctrica del sulfuro de cobre lo suficiente como para extraer una pequeña cantidad de cobre puro de la celda electroquímica de alta temperatura que opera a 1, 105 grados Celsius (2, 021 Fahrenheit). Sokhanvaran es ahora un científico investigador en Natural Resources Canada-Canmet Mining; Lee es investigador principal del Instituto de Investigación de Energía Atómica de Corea; y Lambotte es ahora ingeniero de investigación senior en Boston Electrometallurgical Corp.
"Este documento fue el primero en demostrar que se puede usar una mezcla donde presumiblemente la conductividad electrónica domina la conducción, pero en realidad no existe el 100 por ciento. Hay una pequeña fracción que es iónica, que es lo suficientemente bueno para hacer cobre, "Explica Allanore.
"El nuevo artículo muestra que podemos ir más allá y hacerlo casi completamente iónico, eso es reducir la parte de la conductividad electrónica y por lo tanto aumentar la eficiencia para hacer metal, "Dice Allanore.
Estos minerales de sulfuro son compuestos donde el metal y los elementos de azufre comparten electrones. En su estado fundido, a los iones de cobre les falta un electrón, dándoles una carga positiva, mientras que los iones de azufre llevan dos electrones adicionales, dándoles una carga negativa. La reacción deseada en una celda de electrólisis es formar átomos elementales, agregando electrones a metales como el cobre, y quitar electrones del azufre. Esto sucede cuando el voltaje aplicado introduce electrones adicionales en el sistema. Los iones metálicos reaccionan en el cátodo, un electrodo cargado negativamente, donde obtienen electrones en un proceso llamado reducción; mientras tanto, los iones de azufre cargados negativamente están reaccionando en el ánodo, un electrodo cargado positivamente, donde ceden electrones en un proceso llamado oxidación.
En una celda que usaba solo sulfuro de cobre, por ejemplo, debido a su alta conductividad electrónica, los electrones adicionales simplemente fluirían a través del electrolito sin interactuar con los iones individuales de cobre y azufre en los electrodos y no ocurriría separación. Los investigadores del Grupo Allanore identificaron con éxito otros compuestos de sulfuro que, cuando se agrega al sulfuro de cobre, cambiar el comportamiento de la masa fundida para que los iones, en lugar de electrones, se convierten en los portadores de carga primarios a través del sistema y, por lo tanto, permiten las reacciones químicas deseadas. Tecnicamente hablando, los aditivos aumentan la banda prohibida del sulfuro de cobre para que ya no sea eléctricamente conductor, Chmielowiec explica. La fracción de electrones que participan en las reacciones de oxidación y reducción, medido como porcentaje de la corriente total, ese es el flujo total de electrones en la celda, se llama su eficiencia faradaica.
Duplicando la eficiencia
El nuevo trabajo duplica la eficiencia para la extracción electrolítica de cobre reportada en el primer artículo, que era 28 por ciento con un electrolito donde solo se agrega sulfuro de bario al sulfuro de cobre, al 59 por ciento en el segundo papel con sulfuro de lantano y sulfuro de bario añadidos al sulfuro de cobre.
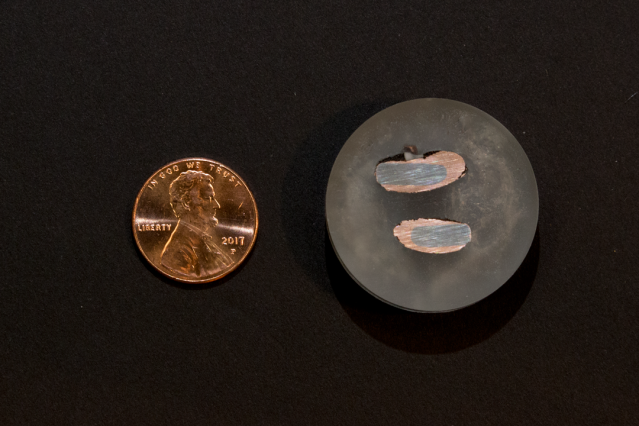
Un centavo nuevo a la izquierda contrasta con muestras de cobre casi puro depositadas sobre un electrodo de hierro después de la extracción mediante un proceso electroquímico. Crédito:Denis Paiste / Centro de procesamiento de materiales
"Demostrar que podemos realizar reacciones faradaicas en un sulfuro metálico líquido es novedoso y puede abrir la puerta para estudiar muchos sistemas diferentes, ", Dice Chmielowiec." Funciona para algo más que cobre. Pudimos hacer renio, y pudimos fabricar molibdeno ". El renio y el molibdeno son metales de importancia industrial que se utilizan en los motores de los aviones a reacción, por ejemplo. El laboratorio de Allanore también utilizó electrólisis fundida para producir zinc, estaño y plata, pero liderar, son posibles el níquel y otros metales, él sugiere.
La cantidad de energía requerida para ejecutar el proceso de separación en una celda de electrólisis es proporcional a la eficiencia faradaica y al voltaje de la celda. Para agua, que fue uno de los primeros compuestos en ser separados por electrólisis, el voltaje mínimo de la celda, o energía de descomposición, es de 1,23 voltios. Sahu y Chmielowiec identificaron los voltajes de celda en su celda como 0.06 voltios para sulfuro de renio, 0,33 voltios para sulfuro de molibdeno, y 0,45 voltios para sulfuro de cobre. "Para la mayoría de nuestras reacciones, aplicamos 0,5 o 0,6 voltios, de modo que los tres sulfuros juntos se reducen a metálicos, renio, molibdeno y cobre, "Sahu explica. A la temperatura de funcionamiento de la celda y a un potencial aplicado de 0,5 a 0,6 voltios, el sistema prefiere descomponer esos metales porque la energía requerida para descomponer tanto el sulfuro de lantano (alrededor de 1,7 voltios) como el sulfuro de bario (alrededor de 1,9 voltios) es comparativamente mucho mayor. Experimentos separados también demostraron la capacidad de reducir selectivamente el renio o el molibdeno sin reducir el cobre, basado en sus diferentes energías de descomposición.
Potencial industrial
Metales estratégicos y de materias primas importantes, incluidos, cobre, zinc, dirigir, renio, y el molibdeno se encuentran típicamente en minerales de sulfuro y menos comúnmente en minerales a base de óxido, como es el caso del aluminio. "Lo que se suele hacer es quemarlos en el aire para eliminar el azufre, pero al hacerlo, produce SO2 [dióxido de azufre], y a nadie se le permite lanzar eso directamente al aire, por lo que tienen que capturarlo de alguna manera. Hay muchos costos de capital asociados con la captura de SO2 y su conversión en ácido sulfúrico, "Explica Chmielowiec.
El proceso industrial más cercano a la extracción de cobre electrolítico que esperan ver es la producción de aluminio mediante un proceso electrolítico conocido como proceso Hall-Héroult. que produce un charco de metal de aluminio fundido que puede ser golpeado continuamente. "Lo ideal es ejecutar un proceso continuo, "Dice Chmielowiec". en nuestro caso, mantendría un nivel constante de cobre líquido y luego lo sacaría periódicamente de la celda de electrólisis. Se ha dedicado mucha ingeniería a eso para la industria del aluminio, así que, con suerte, podríamos aprovechar eso ".
Sahu y Chmielowiec realizaron sus experimentos en 1, 227 C, unos 150 grados centígrados por encima del punto de fusión del cobre. Es la temperatura comúnmente utilizada en la industria para la extracción de cobre.
Futuras mejoras
Los sistemas de electrólisis de aluminio funcionan con una eficiencia faradaica del 95 por ciento, por lo que hay margen de mejora con respecto a la eficiencia del 59 por ciento informada por los investigadores. Para mejorar su eficiencia celular, Sahu dice:pueden necesitar modificar el diseño de la celda para recuperar una mayor cantidad de cobre líquido. El electrolito también se puede ajustar más, añadir sulfuros distintos del sulfuro de bario y el sulfuro de lantano. "No existe una única solución que nos permita hacer eso. Será una optimización para llevarlo a una escala mayor, ", Dice Chmielowiec. Ese trabajo continúa.
Sahu, 34, recibió su doctorado en química de la Universidad de Madrás, En India. Chmielowiec, 27, estudiante de doctorado de segundo año y becario Salapatas en ciencia e ingeniería de materiales, recibió su licenciatura en ingeniería química en el MIT en 2012 y una maestría en ingeniería química de Caltech en 2014.
El trabajo encaja en el trabajo del Grupo Allanore sobre materiales fundidos a alta temperatura, incluidos los avances recientes en el desarrollo de nuevas fórmulas para predecir la semiconductividad en compuestos fundidos y la demostración de una celda termoeléctrica fundida para producir electricidad a partir del calor residual industrial. El Grupo Allanore está buscando una patente sobre ciertos aspectos del proceso de extracción.
Obra novedosa y significativa
"Utilizando un diseño inteligente de la química del proceso, Estos investigadores han desarrollado una ruta muy novedosa para producir cobre, "dice Rohan Akolkar, el Profesor Asociado F. Alex Nason de Ingeniería Química y Biomolecular en la Universidad Case Western Reserve, que no estuvo involucrado en este trabajo. "Los investigadores han diseñado un proceso que tiene muchos de los ingredientes clave:es un limpiador, escalable y un proceso de un solo paso más simple para producir cobre a partir de mineral de sulfuro ".
"Tecnológicamente, los autores aprecian la necesidad de hacer el proceso más eficiente preservando la pureza intrínseca del cobre producido, "dice Akolkar, que visitó el laboratorio de Allanore a fines del año pasado. "Si la tecnología se desarrolla más y su tecnoeconomía parece favorable, entonces puede proporcionar una vía potencial para una producción más simple y limpia de cobre metálico, lo cual es importante para muchas aplicaciones ". Akolkar señala que" la calidad de este trabajo es excelente. El grupo de investigación Allanore en el MIT está a la vanguardia cuando se trata de avanzar en la investigación de electrólisis de sales fundidas ".
El profesor de ingeniería química de la Universidad de Rochester, Jacob Jorné, dice:"Los procesos de extracción actuales implican varios pasos y requieren una gran inversión de capital, por tanto, se prohíben las mejoras costosas. La electrólisis directa de los minerales de sulfuro metálico también es ventajosa, ya que elimina la formación de dióxido de azufre. un contaminante de lluvia ácida. "
"La electroquímica y la termodinámica en las sales fundidas son bastante diferentes a las de los sistemas acuosos [basados en agua] y la investigación de Allanore y su grupo demuestra que se ha ignorado una gran cantidad de buena química en el pasado debido a nuestra devoción servil por el agua, "Sugiere Jorné." La electrólisis directa de minerales metálicos abre el camino a un renacimiento metalúrgico donde se pueden implementar nuevos descubrimientos y procesos y se puede modernizar la industria de extracción envejecida y mejorar su eficiencia energética. El nuevo enfoque se puede aplicar a otros metales de gran importancia estratégica, como los metales de tierras raras ".
Esta historia se vuelve a publicar por cortesía de MIT News (web.mit.edu/newsoffice/), un sitio popular que cubre noticias sobre la investigación del MIT, innovación y docencia.