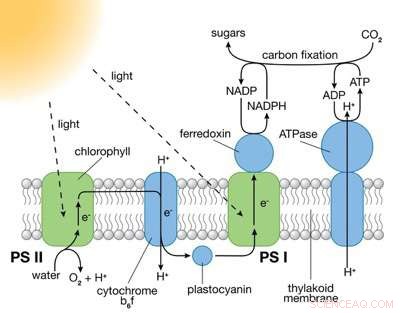
Los fotosistemas (PS) I y II son grandes complejos de proteínas que contienen moléculas de pigmento que absorben la luz necesarias para la fotosíntesis. PS II captura energía de la luz solar para extraer electrones de las moléculas de agua. dividiendo el agua en iones de oxígeno e hidrógeno (H +) y produciendo energía química en forma de ATP. PS I usa esos electrones y H + para reducir NADP + (una molécula portadora de electrones) a NADPH. La energía química contenida en ATP y NADPH se utiliza luego en la reacción de fotosíntesis independiente de la luz para convertir el dióxido de carbono en azúcares. Crédito:Laboratorio Nacional Brookhaven
La fotosíntesis en las plantas verdes convierte la energía solar en energía química almacenada al transformar el dióxido de carbono atmosférico y el agua en moléculas de azúcar que alimentan el crecimiento de las plantas. Los científicos han intentado replicar artificialmente este proceso de conversión de energía, con el objetivo de producir combustibles sostenibles y respetuosos con el medio ambiente, como hidrógeno y metanol. Pero imitando funciones clave del centro fotosintético, donde biomoléculas especializadas realizan la fotosíntesis, ha demostrado ser un desafío. La fotosíntesis artificial requiere diseñar un sistema molecular que pueda absorber la luz, transporte y carga eléctrica separada, y catalizar reacciones de producción de combustible, todos procesos complicados que deben operar de manera sincrónica para lograr una alta eficiencia de conversión de energía.
Ahora, Los químicos del Laboratorio Nacional Brookhaven del Departamento de Energía de EE. UU. (DOE) y Virginia Tech han diseñado dos fotocatalizadores (materiales que aceleran las reacciones químicas al absorber la luz) que incorporan componentes individuales especializados para la absorción de la luz, separación de carga, o catálisis en una única "supramolécula". En ambos sistemas moleculares, múltiples centros de captación de luz hechos de iones metálicos de rutenio (Ru) están conectados a un único centro catalítico hecho de iones metálicos de rodio (Rh) a través de una molécula puente que promueve la transferencia de electrones desde los centros de Ru al catalizador Rh, donde se produce el hidrógeno.
Compararon el rendimiento de la producción de hidrógeno y analizaron las propiedades físicas de las supramoléculas, como se describe en un artículo publicado en la edición en línea del 1 de junio de Revista de la Sociedad Química Estadounidense , para comprender por qué el fotocatalizador con seis absorbedores de luz en lugar de tres Ru produce más hidrógeno y permanece estable durante un período de tiempo más largo.
"Desarrollar sistemas moleculares eficientes para la producción de hidrógeno es difícil porque los procesos ocurren a diferentes velocidades, "dijo el autor principal Gerald Manbeck, químico del grupo de fotosíntesis artificial del Brookhaven Lab. "Completar la renovación catalítica del hidrógeno antes de que las cargas separadas (el electrón excitado por luz cargado negativamente y el" agujero "positivo que queda después de que la molécula excitada absorba energía lumínica) tengan la oportunidad de recombinarse y producir calor de manera inútil es uno de los principales desafíos. "
Otra complicación es que se necesitan dos electrones para producir cada molécula de hidrógeno. Para que ocurra la catálisis, el sistema debe poder retener el primer electrón el tiempo suficiente para que aparezca el segundo. "Al construir supramoléculas con múltiples absorbentes de luz que pueden funcionar de forma independiente, estamos aumentando la probabilidad de utilizar cada electrón de manera productiva y mejorando la capacidad de las moléculas para funcionar en condiciones de poca luz, "dijo Manbeck.
Manbeck comenzó a fabricar supramoléculas en Virginia Tech en 2012 con la fallecida Karen Brewer, coautor y su asesor postdoctoral. Descubrió que el sistema de cuatro metales (tetrametálico) con tres centros de absorción de luz Ru y un centro catalítico de Rh producía solo 40 moléculas de hidrógeno por cada molécula de catalizador y dejaba de funcionar después de unas cuatro horas. En comparación, el sistema de siete metales (heptametálico) con seis centros Ru y un centro Rh era más de siete veces más eficiente, ciclando 300 veces para producir hidrógeno durante 10 horas. Esta gran disparidad en eficiencia y estabilidad fue desconcertante porque las supramoléculas contienen componentes muy similares.
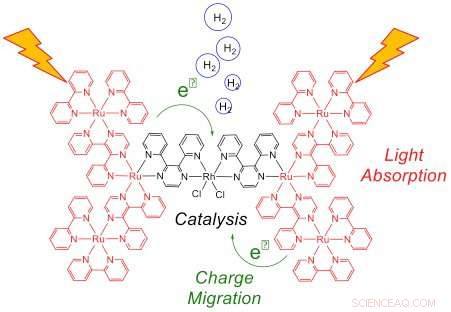
Esta representación del sistema heptametálico tras la exposición a la luz muestra la captación de luz por los seis centros Ru (rojo) y la transferencia de electrones al catalizador Rh (negro), donde se produce el hidrógeno. La transferencia eficiente de electrones a Rh es esencial para lograr un alto rendimiento catalítico. Crédito:Laboratorio Nacional Brookhaven
Manbeck se unió a Brookhaven en 2013 y desde entonces ha llevado a cabo una serie de experimentos con el coautor Etsuko Fujita, líder del grupo de fotosíntesis artificial, comprender las causas fundamentales de la diferencia en el rendimiento.
"La capacidad de formar el estado de carga separada es un indicador parcial de si una supramolécula será un buen fotocatalizador, pero darse cuenta de una separación de carga eficiente requiere un ajuste fino de la energía de cada componente, "dijo Fujita." Para promover la catálisis, el catalizador Rh debe tener una energía lo suficientemente baja para aceptar los electrones de los absorbedores de luz Ru cuando los absorbentes se exponen a la luz ".
A través de voltamperometría cíclica, una técnica electroquímica que muestra los niveles de energía dentro de una molécula, los científicos encontraron que el catalizador Rh del sistema heptametálico es un poco más pobre en electrones y, por lo tanto, más receptivo a recibir electrones que su contraparte en el sistema tetrametálico. Este resultado sugirió que la transferencia de carga fue favorable en el sistema heptametálico pero no en el tetrametálico.
Verificaron su hipótesis con una técnica de resolución temporal llamada espectroscopia de absorción transitoria de nanosegundos. en el que una molécula es promovida a un estado excitado por un intenso pulso de láser y se mide la desintegración del estado excitado a lo largo del tiempo. Los espectros resultantes revelaron la presencia de una transferencia de carga de Ru a Rh solo en el sistema heptametálico.
"Los datos no solo confirmaron nuestra hipótesis, sino que también revelaron que la separación de carga en estado excitado ocurre mucho más rápidamente de lo que habíamos imaginado, "dijo Manbeck." De hecho, la migración de carga ocurre más rápido que la resolución de tiempo de nuestro instrumento, y probablemente implica de corta duración, estados excitados de alta energía ". Los investigadores planean buscar un colaborador con instrumentación más rápida que pueda medir la tasa exacta de separación de carga para ayudar a aclarar el mecanismo.
En un experimento de seguimiento, los científicos realizaron la medición de la absorción transitoria en condiciones de funcionamiento fotocatalíticas, with a reagent used as the ultimate source of electrons to produce hydrogen (a scalable artificial photosynthesis of hydrogen fuel from water would require replacing the reagent with electrons released during water oxidation). The excited state generated by the laser pulse rapidly accepted an electron from the reagent. They discovered that the added electron resides on Rh in the heptametallic system only, further supporting the charge migration to Rh predicted by cyclic voltammetry.
"The high photocatalytic turnover of the heptametallic system and the principles governing charge separation that were uncovered in this work encourage further studies using multiple light-harvesting units linked to single catalytic sites, " said Manbeck.