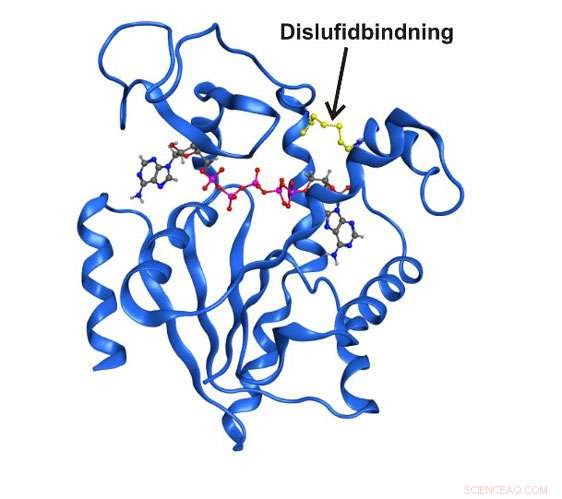
Estructura de rayos X de alta resolución de la enzima adenilato quinasa atrapada en un estado estructural transitorio por un enlace disulfuro covalente. Crédito:Universidad de Umea
Los químicos de la Universidad de Umeå han logrado mapear las estructuras y funciones de un estado enzimático transitorio. Modificando la enzima adenilato quinasa, los investigadores pudieron aislar la molécula y estudiarla utilizando las técnicas cuantitativas de cristalografía de rayos X y espectroscopía de resonancia magnética nuclear (RMN). Los resultados se han publicado en la revista PNAS .
"Ahora hemos dado un paso más hacia una comprensión general de cómo funcionan las enzimas. Esto es vital para los diseños futuros de nuevas enzimas en aplicaciones biotecnológicas, "dice Magnus Wolf-Watz, profesor asociado del Departamento de Química de la Universidad de Umeå.
La vida biológica depende de una gran cantidad de células, reacciones químicas que a menudo son extremadamente lentas y pueden tardar meses o años en completarse. Para que coincidan las escalas de tiempo químicas y biológicas, Las reacciones químicas se aceleran en las células con el uso de enzimas como biocatalizadores eficientes.
Durante la última década de investigación, se ha dejado claro que las estructuras enzimáticas que solo existen breve y transitoriamente pueden ser completamente esenciales para la función catalítica. Hasta aquí, no ha sido posible estudiar estos estados en detalle debido al simple hecho de que son invisibles a las técnicas espectroscópicas tradicionales. Ahora, Los investigadores del Departamento de Química de la Universidad de Umeå en Suecia han logrado capturar un estado transitorio central para la función en la enzima esencial adenilato quinasa. El estado a corto plazo fue posible enriquecer intercambiando dos aminoácidos en la enzima con el aminoácido reactivo cisteína.
"Es la primera vez que alguien ha logrado estudiar un estado enzimático transitorio directamente utilizando técnicas espectroscópicas y cuantitativas. Con el uso de nuestros métodos, pudimos describir en detalle tanto la estructura como la función de la enzima en la fase transitoria específica, "dice Magnus Wolf-Watz, quien dirigió el estudio junto con el postdoctorado Michael Kovermann, quien ahora tiene un liderazgo de grupo en la Universidad de Konstanz en Alemania.
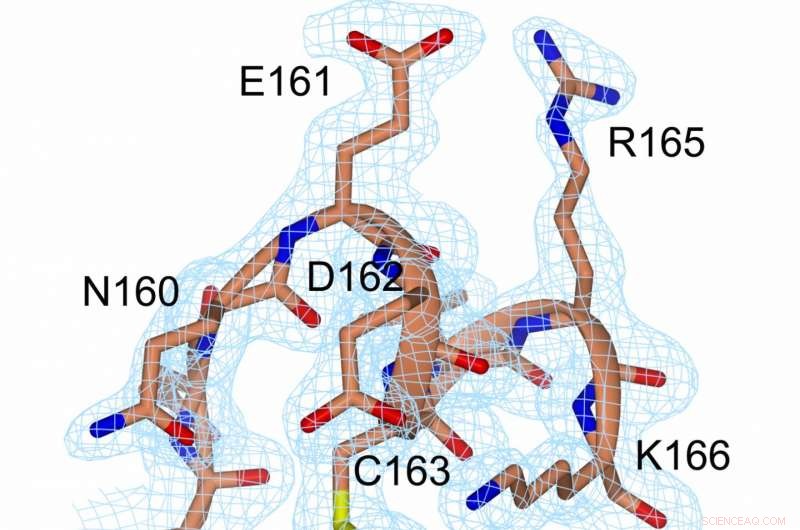
Una representación de la densidad de electrones en el enlace disulfuro (amarillo, entre C56 y C163) y en sus inmediaciones. Crédito:Prof. Michael Kovermann, Universidad de Konstanz
Los resultados indicaron que la función en una enzima depende completamente de su dinámica inherente, y sin dinámica, la enzima se volvería inútil. Es más, resultó que el estado transitorio unía sus moléculas de sustrato mucho más fuerte que las proteínas naturales. Los resultados nos dieron más pistas sobre cómo las enzimas pueden acelerar las reacciones con una especificidad y eficacia tan increíbles. Todo el rato, el método que desarrollamos puede ser útil en general en estudios de otras enzimas ".
El equipo de RMN de Magnus Wolf Watz ha colaborado con los cristalógrafos de rayos X Uwe H. Sauer y Elisabeth Sauer-Eriksson en el estudio.
"Hemos tenido una colaboración a largo plazo y muy productiva. Este es un buen ejemplo de lo importante que es la atmósfera de colaboración que se encuentra en la Universidad de Umeå, y cómo debemos apreciarlo y desarrollarlo aún más en el futuro, "dice Magnus Wolf-Watz.