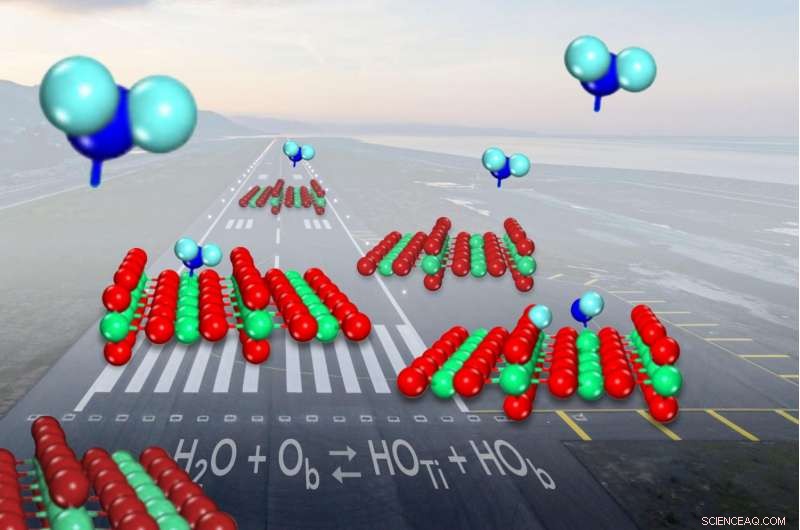
Cuando el agua (que se muestra en azul) entra para aterrizar en el catalizador común de óxido de titanio (que se muestra en rojo y verde), se divide en hidroxilos (en la superficie hacia la izquierda) poco menos de la mitad del tiempo. Crédito:Zdenek Dohnalek
Cuando una molécula de agua aterriza en el catalizador común óxido de titanio, a veces se rompe y forma un par de fragmentos de moléculas conocidos como hidroxilos. Pero los científicos no habían podido demostrar con qué frecuencia ocurría la ruptura. Ahora, Los investigadores han determinado que es sólo un poco más probable que el agua permanezca en una sola pieza cuando se une a la superficie del catalizador que para formar los pares de hidroxilo.
El resultado —la ventaja del agua es tan pequeña— podría sorprender a algunos químicos. Pero comprender esa pequeña ventaja tiene una gran importancia para una variedad de aplicaciones potenciales en industrias que usan dióxido de titanio. Estas industrias incluyen la producción de combustibles alternativos, energía solar y seguridad alimentaria, e incluso ventanas autolimpiables. También ayudará a los científicos a comprender mejor cómo se comportan los ácidos y ampliar sus conocimientos sobre cómo se dividen las moléculas.
"Cómo se une el agua fue la gran pregunta, ", dijo el químico Zdenek Dohnalek del Laboratorio Nacional del Noroeste del Pacífico del Departamento de Energía." Los químicos tenían información mixta de muchos métodos diferentes, y los teóricos también tenían ideas. Usando una combinación única de instrumentos, finalmente lo hemos resuelto ".
El equipo informó del trabajo en el procedimientos de la Academia Nacional de Ciencias .
Tierra de misterio
Aunque muchas industrias usan óxido de titanio para ayudar a acelerar las reacciones químicas, los científicos no han descubierto todos sus secretos. Un misterio clave los investigadores han debatido durante mucho tiempo, es la forma en que el agua interactúa con el óxido de titanio. La interacción es importante por derecho propio para dividir el agua, pero también influye en el curso de muchas reacciones en general.
Sobre la superficie del óxido de titanio, Las moléculas de agua cambian entre estar intactas y dividirse en hidroxilos. Aunque hay muchas formas diferentes de medir la proporción de agua intacta a hidroxilos en un momento dado, los científicos no han podido precisarlo durante décadas.
Para explorar el problema, Los investigadores de PNNL combinaron diferentes herramientas de una manera nueva. Enviaron haces de agua a varias velocidades sobre óxido de titanio frío bajo un microscopio de muy alta resolución conocido como microscopio de efecto túnel.
El microscopio les permitió visualizar los átomos de titanio y oxígeno del catalizador. Los átomos aparecen como filas brillantes y oscuras, como un maizal con altas hileras de maíz alternadas con acequias, y las moléculas individuales de agua aparecen como puntos brillantes que no se alinean con las filas.
Además de ver las moléculas de agua cuando golpean la superficie, el equipo simuló detalles de los átomos que interactúan con gran detalle en una computadora de alto rendimiento. La combinación de experimentos y simulaciones permitió al equipo resolver el debate de larga data.
Atracción instantánea
Con forma de V una molécula de agua tiene un átomo de oxígeno graso en el medio unido a dos átomos de hidrógeno más pequeños a cada lado. El óxido de titanio ayuda a romper los enlaces entre los átomos para impulsar una reacción química:los átomos de titanio atrapan moléculas de agua, mientras que los oxígenos cercanos, también forma parte de la superficie del catalizador, se aleja y luego captura uno de los átomos de hidrógeno.
Cuando esto pasa, se forman dos hidroxilos, uno de un oxígeno de la superficie que se combina con el hidrógeno y el otro sobrante de la molécula de agua.
Los científicos necesitaban saber con qué frecuencia se formaban los hidroxilos. ¿Las moléculas de agua permanecen en gran parte intactas en la superficie? ¿O se convierten inmediatamente en hidroxilos? La probabilidad de que el agua permanezca intacta sobre el óxido de titanio y la facilidad con la que los hidroxilos se transforman en agua prepara el escenario para otras reacciones químicas.
Descubrir, los químicos tuvieron que desarrollar tecnologías para medir la frecuencia con la que aparecían los hidroxilos en la superficie. Usando recursos desarrollados dentro de EMSL, el Laboratorio de Ciencias Moleculares Ambientales, una instalación para usuarios de la Oficina de Ciencias del DOE en PNNL, dispararon un rayo de moléculas de agua a una superficie de óxido de titanio a baja energía; el rayo se disparó lentamente, ya alta energía, moviéndose rápido como si saliera de una manguera de incendios.
Terminaron con puntos brillantes en la superficie, y cuanto mayor sea la energía, más manchas. Pero las manchas no parecían lo suficientemente brillantes como para incluir ambos hidroxilos, como se esperaba, por lo que realizaron experimentos adicionales para determinar cuáles eran las manchas.
Correcto
El equipo disparó agua a la superficie del dióxido de titanio y luego congeló el agua en su lugar. Luego calentaron todo lentamente. El aumento de la temperatura reveló que las manchas, que pensaban que eran al menos un hidroxilo, se transformaban en moléculas de agua. Esto significaba que cada mancha tenía que ser en realidad un par de hidroxilos porque la evidencia mostraba que todas las materias primas necesarias para hacer una molécula de agua estaban allí. y se necesitaban ambos hidroxilos.
Realizaron varios otros experimentos para determinar la temperatura a la que una molécula de agua de aterrizaje se convierte en pares de hidroxilo y viceversa. De eso aprendieron que el agua es solo un poco más estable que los pares de hidroxilos en la superficie:un 10 por ciento más, si nos fijamos en la cantidad de energía que se necesita para interrumpirlos.
Simulando los aterrizajes en el agua en una computadora de alto rendimiento, también en EMSL, los investigadores descubrieron que las únicas moléculas de agua que se adhirieron al catalizador fueron las que aterrizaron en una zanja figurativa dentro de un campo de maíz, donde el oxígeno del agua se enfrentaba a un átomo de titanio en la zanja.
Si el agua entrara con la velocidad adecuada, el agua se reorientó y atracó uno de sus hidrógenos hacia un oxígeno cercano, formando los pares de hidroxilo vistos en los experimentos. Que no, la molécula de agua acaba de rebotar.
"Descubrimos que la electrostática, la misma estática que produce chispas cuando frotas los pies sobre la alfombra, ayudó a dirigir las moléculas de agua hacia la superficie, ", dijo el químico teórico y coautor Roger Rousseau.
Todos estos detalles ayudarán a los investigadores a comprender mejor la catálisis y mejorarán nuestra comprensión de las reacciones químicas. Además, Los resultados revelan un valor que los científicos han tratado de precisar durante mucho tiempo:qué tan fácil o difícil es para el agua perder un hidrógeno en el óxido de titanio.