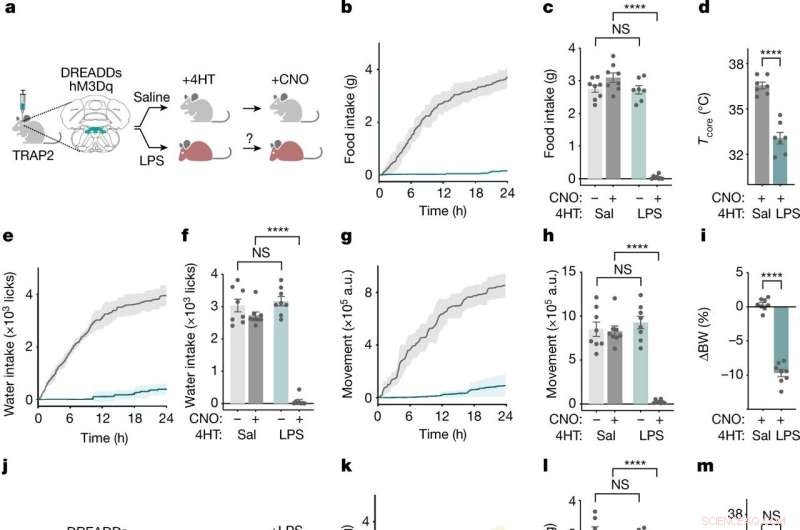
Las neuronas NTS-AP regulan el comportamiento de enfermedad. un , Método para el etiquetado de TRAP2 y la reactivación de neuronas NTS-AP mediante la activación de hM3Dq (Gq) DREADD. Ratón gris, normal; ratón rojo, enfermo. b ,e ,g , Ingesta acumulada de alimentos (b ), toma de agua (e ) y movimiento (g ) durante 24 h después de la reactivación de las neuronas marcadas con solución salina (gris) y LPS (cian). c ,f ,h , Ingesta de alimentos (c ) (ANOVA P < 1 × 10 −7 ), toma de agua (f ) (ANOVA P < 1 × 10 −7 ) y movimiento (h ) (ANOVA P < 1 × 10 −7 ) a las 12 h después de la inyección de CNO para la reactivación de las neuronas marcadas con solución salina (gris oscuro) y LPS (cian oscuro); También se muestran los controles de solución salina para la administración de CNO (gris claro; cian claro). d ,yo , Cambio en la temperatura central (t no apareados -prueba P = 4.6 × 10 −6 ) 4 h después de la reactivación (d ) y porcentaje de peso corporal (t no apareados -prueba P < 1 × 10 −7 ) 24 h después de la reactivación (i ) de neuronas marcadas con solución salina (gris) y LPS (cian). En todos los paneles, animales etiquetados con solución salina, n = 8; animales marcados con LPS, n = 7. j , Esquema del etiquetado e inactivación de TRAP2 usando DREADD hM4Di (Gi) inhibitorios durante la exposición simultánea a LPS. k ,n ,p , Ingesta acumulada de alimentos (k ), toma de agua (n ) y movimiento (p ) durante 24 h después de la inhibición basada en CNO y el tratamiento simultáneo con LPS (0,5 mg kg −1 , i.p.) de neuronas marcadas con solución salina (gris) y LPS (amarillo oscuro). Se muestra el tratamiento con solución salina de las neuronas marcadas con LPS (amarillo claro) como referencia. l ,o ,q , Ingesta de alimentos (l ) (ANOVA P = 2.9 × 10 −7 ), toma de agua (o ) (ANOVA P = 2.1 × 10 −7 ) y movimiento (g ) (ANOVA P = 3.3 × 10 −4 ) a las 12 h post inhibición y tratamiento con LPS concurrente (0.5 mg kg −1 , i.p.) de neuronas marcadas con solución salina (gris oscuro) y LPS (amarillo oscuro); También se muestran controles de solución salina para la administración de CNO (gris claro, amarillo claro). m ,r , Cambio en la temperatura central (t no apareados -test, NS) 4 h después (m ) y porcentaje de peso corporal (t no apareados -prueba, P = 3,2 × 10 −5 ) 24 h después (r ) inhibición y tratamiento con LPS concurrente de neuronas marcadas con solución salina (gris) y LPS (amarilla). En todos los paneles, animales etiquetados con solución salina, n = 7; animales marcados con LPS, n = 7.***P <0.001, ****P <0,0001 y NS, no significativo (P> 0,05). Todas las barras de error representan sem. Crédito:Naturaleza (2022). DOI:10.1038/s41586-022-05161-7
Tendemos a comer, beber y movernos menos cuando nos sentimos mal. Y no estamos solos:la mayoría de los animales reducen esos mismos tres comportamientos cuando luchan contra una infección.
Ahora, un nuevo estudio identifica el grupo de neuronas que controlan estas respuestas, denominadas conductas de enfermedad. Al provocar respuestas inmunitarias en ratones, los investigadores demostraron que una población específica de células en el tronco encefálico induce de manera potente tres conductas de enfermedad reveladoras. Además, la inhibición de estas neuronas mitiga cada uno de estos elementos conductuales de la respuesta a la enfermedad. Los hallazgos, publicados en Nature , vinculan directamente la inflamación con las vías neuronales que regulan el comportamiento, lo que ofrece información sobre cómo el sistema inmunitario interactúa con el cerebro.
"Todavía estamos en los primeros días de tratar de comprender el papel del cerebro en la infección", dice Jeffrey M. Friedman, profesor de Marilyn M. Simpson en la Universidad Rockefeller. "Pero con estos resultados, ahora tenemos una oportunidad única para preguntar:¿Cómo se ve tu cerebro cuando estás enfermo?"
Se ha demostrado que los comportamientos de enfermedad juegan un papel importante en la recuperación de un animal de una infección. Estudios anteriores han reforzado esa teoría al demostrar que los animales obligados a comer cuando están enfermos mostraron una mortalidad significativamente mayor. "Estos cambios de comportamiento durante la infección son realmente importantes para la supervivencia", dice el autor principal Anoj Ilanges, exestudiante graduado en el laboratorio de Friedman, ahora líder de grupo en el Campus de Investigación Janelia del HHMI
Pero nunca ha estado claro cómo el cerebro coordina ese impulso casi universal de rechazar las comidas y acurrucarse bajo las sábanas con el inicio de la infección. Entonces, Friedman e Ilanges se propusieron mapear las regiones del cerebro detrás de los comportamientos de enfermedad en ratones.
El equipo comenzó exponiendo a los ratones a LPS, un trozo de pared celular bacteriana que activa el sistema inmunitario e induce de manera potente el comportamiento de enfermedad. Poco después de una inyección de LPS, hubo un aumento en la actividad en una región del tronco encefálico conocida como complejo vagal dorsal, entre una población de neuronas que expresan el neuropéptido ADCYAP1. Para confirmar que habían encontrado las células cerebrales adecuadas, los investigadores activaron esas neuronas en ratones sanos y descubrieron que los animales comían, bebían y se movían menos. Por el contrario, cuando se desactivaron las neuronas ADCYAP1, el efecto de LPS en estos comportamientos se redujo significativamente.
"No sabíamos si las mismas o diferentes neuronas regulaban cada uno de estos comportamientos", dice Friedman, "Nos sorprendió que una sola población neuronal pareciera regular cada uno de estos componentes de la respuesta a la enfermedad".
Sin embargo, los autores no se sorprendieron del todo de que esta región del tronco encefálico estuviera involucrada en la mediación de los comportamientos de enfermedad. El complejo vagal dorsal es uno de los pocos cruces fisiológicos del sistema nervioso central, donde la ausencia de la barrera hematoencefálica permite que los factores circulantes en la sangre pasen información directamente al cerebro. "Esta región se ha convertido en una especie de centro de alerta para el cerebro, que transmite información sobre sustancias aversivas o nocivas que, en la mayoría de los casos, reducen la ingesta de alimentos", dice Friedman.
En los próximos meses, el equipo de Friedman en Rockefeller tiene la intención de incorporar estos hallazgos en su objetivo general de comprender las señales fisiológicas y los circuitos neuronales que regulan el comportamiento de alimentación. Están específicamente interesados en comprender por qué incluso los ratones diseñados para comer vorazmente dejan de comer cuando se exponen a infecciones bacterianas.
Mientras tanto, Ilanges planea investigar qué papel juegan otras regiones del cerebro en respuesta a las infecciones, ampliando nuestro conocimiento del papel del cerebro durante este proceso crítico. "Observamos una región del cerebro, pero hay muchas otras que se activan con la respuesta inmunitaria", dice. "Esto abre la puerta a preguntar qué está haciendo el cerebro, de manera integral, durante la infección". Neuronas en el tronco encefálico que regulan los síntomas de la enfermedad encontradas en un modelo de ratón