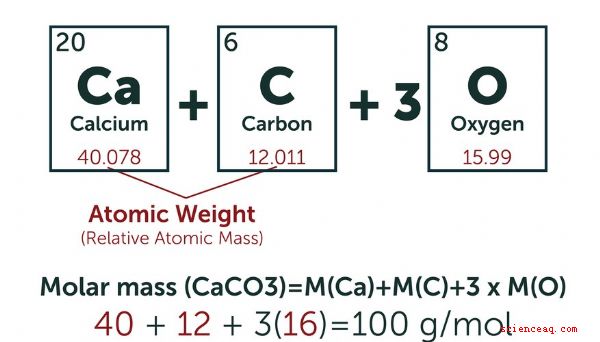
Para simplificar sus cálculos, los químicos crearon una unidad estándar para la cantidad de átomos de un compuesto particular involucrado en una reacción o en algún otro proceso químico. Definen un mol (mol) como la cantidad de cualquier sustancia que tiene el mismo número de unidades fundamentales que 12 gramos de carbono-12, que es el número de Avogadro (6.022 × 10 23). El sistema de medida SI (métrico) define un milimole (Mmol) como una milésima de un mol. En general, calcula la cantidad de moles de una sustancia al pesar la cantidad que tiene a mano. Si quiere convertir a Mmol, multiplique por 10 3 (1,000). TL; DR (Demasiado tiempo; no lo leyó) Un lunar es igual al número de Avogadro de partículas de un compuesto particular. Un milimole (Mmol) es una milésima de un mol. Cómo calcular los lunares Las masas atómicas se miden en unidades de masa atómica (AMU). Una AMU es exactamente 1/12 de la masa del núcleo de un átomo de carbono 12 en su estado fundamental. Una mole de una sustancia se define como igual al número de partículas de Avogadro de esa sustancia. Según esta definición, el peso de una mol de una sustancia en gramos es el mismo que el peso de una partícula individual de esa sustancia en la AMU. Por ejemplo, el peso atómico del carbono 12 es 12 AMU, por lo que una mol de carbono 12 pesa 12 gramos. Considere un recipiente lleno de gas hidrógeno (H 2). Cada partícula en el contenedor es una molécula que consta de dos átomos de hidrógeno, por lo que solo se necesita conocer la masa atómica de hidrógeno para calcular el peso molecular. La mayoría de las versiones de la tabla periódica enumeran la masa atómica de cada elemento bajo su símbolo. Para el hidrógeno, que tiene un solo protón en su núcleo, es 1.008 AMU, que es un promedio de todos los isótopos naturales del hidrógeno. En consecuencia, la masa atómica de gas de hidrógeno es 2.016 AMU, y una mol de gas de hidrógeno pesa 2.016 gramos. Para encontrar la cantidad de moles en su muestra, pesaría la muestra en gramos y dividiría ese peso por el peso molecular de gas de hidrógeno en gramos. Por ejemplo, una muestra que pesa 15 gramos de gas hidrógeno puro contiene 7,44 moles. Convertir a Mmol A veces, las cantidades investigadas son tan pequeñas que su expresión en moles es engorrosa. Ingresa el milimol. Al multiplicar el número de moles por mil, puede convertir un número muy pequeño en uno más manejable. Esto es especialmente conveniente cuando se trata de unidades de volumen del orden de mililitros. 1 mol = 1.000 Mmol Concentración de solución Los químicos usan la molaridad como una medida de concentración de un compuesto particular en solución. Definen la molaridad como el número de moles por litro. Convierte la molaridad en millimolaridad multiplicando por 1,000. Por ejemplo, una solución de 1 mol (molar, también escrito como M) tiene una concentración de 1 mol por litro. Esto es equivalente a una solución de 1,000 Mmol (milimolar, también a veces escrito como mM), que es uno que contiene 1,000 Mmoles por litro. Ejemplo Una solución contiene 0.15 gramos de carbonato de calcio. ¿Cuántos milimoles es ese? La fórmula química del carbonato de calcio es CaCO 3. El peso atómico del carbono (C) es de aproximadamente 12 AMU, el del oxígeno (O) aproximadamente 16 AMU y el del calcio (Ca) de aproximadamente 40 AMU. Cada molécula de carbonato de calcio pesa 100 AMU, lo que significa que un mol pesa aproximadamente 100 gramos. Un peso de 0,15 gramos representa 0,15 g \\ cdot 100 g /mol = 0,0015 moles. Esto es equivalente a 1.5 Mmol. ¿Cuál es la molaridad y milimolaridad de este mucho carbonato de calcio en 2.5 litros de solución? La molaridad se define como el número de moles por litro, así que divida la número de moles por 2.5 para obtener la molaridad: 0.0015 ÷ 2.5 = 0.0006 M Multiplique por 1,000 para obtener la milimolaridad = 0.6 mM Tenga en cuenta que obtendrá el mismo resultado para la milimolaridad si divide el número de milimoles por el volumen de solución.