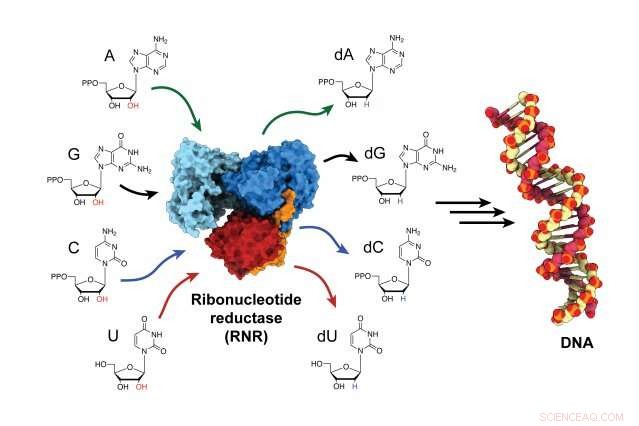
La enzima ribonucleótido reductasa (RNR) es responsable de convertir los componentes básicos del ARN en componentes básicos del ADN, y es un actor fundamental tanto en la síntesis como en la reparación del ADN en todos los organismos. Crédito:Gyunghoon "Kenny" Kang
¿Cómo se captura un proceso celular que ocurre en un abrir y cerrar de ojos? Los bioquímicos del MIT han ideado una forma de atrapar y visualizar una enzima vital en el momento en que se activa, informando el desarrollo de fármacos y revelando cómo los sistemas biológicos almacenan y transfieren energía.
La enzima ribonucleótido reductasa (RNR), es responsable de convertir los bloques de construcción de ARN en bloques de construcción de ADN, para construir nuevas hebras de ADN y reparar las viejas. RNR es un objetivo para las terapias contra el cáncer, así como medicamentos que tratan enfermedades virales como el VIH / SIDA. Pero durante décadas Los científicos lucharon por determinar cómo se activa la enzima porque sucede muy rápido. Ahora, por primera vez, Los investigadores han atrapado la enzima en su estado activo y han observado cómo la enzima cambia de forma, acercando sus dos subunidades y transfiriendo la energía necesaria para producir los bloques de construcción para el ensamblaje del ADN.
Antes de este estudio, muchos creían que las dos subunidades de RNR se unían y encajaban con una simetría perfecta, como una llave en una cerradura. "Durante 30 años, eso es lo que pensamos, "dice Catherine Drennan, profesor de química y biología del MIT e investigador del Instituto Médico Howard Hughes. "Pero ahora, podemos ver que el movimiento es mucho más elegante. La enzima en realidad está realizando una 'danza molecular cuadrada, 'donde diferentes partes de la proteína se enganchan y giran alrededor de otras partes. Es realmente bastante hermoso ".
Drennan y JoAnne Stubbe, profesor emérita de química y biología en el MIT, son los autores principales del estudio, que apareció en la revista Ciencias el 26 de marzo. El ex estudiante de posgrado Gyunghoon "Kenny" Kang Ph.D. '19 es el autor principal.
Todas las proteínas, incluyendo RNR, se componen de unidades fundamentales conocidas como aminoácidos. Por mas de una decada, El laboratorio de Stubbe ha estado experimentando con la sustitución de aminoácidos naturales de RNR por aminoácidos sintéticos. Al hacerlo, el laboratorio se dio cuenta de que podían atrapar la enzima en su estado activo y ralentizar su regreso a la normalidad. Sin embargo, No fue hasta que el laboratorio de Drennan obtuvo acceso a un avance tecnológico clave, la microscopía crioelectrónica, que pudieron tomar imágenes de alta resolución de estas enzimas "atrapadas" del laboratorio de Stubbe y observarlas más de cerca.
"Realmente no habíamos realizado ninguna microscopía crioelectrónica en el momento en que comenzamos a intentar activamente hacer lo imposible:obtener la estructura de RNR en su estado activo, "Drennan dice." No puedo creer que haya funcionado; Todavía me estoy pellizcando ".
La combinación de estas técnicas permitió al equipo visualizar la compleja danza molecular que permite a la enzima transportar la "potencia de fuego" catalítica de una subunidad a la siguiente. para generar bloques de construcción de ADN. Esta potencia de fuego se deriva de un electrón desapareado altamente reactivo (un radical), que debe controlarse cuidadosamente para evitar daños a la enzima.
Según Drennan, el equipo "quería ver cómo RNR hace el equivalente a jugar con fuego sin quemarse".
El primer autor, Kang, dice que ralentizar la transferencia de radicales les permitió observar partes de la enzima que nadie había podido ver antes en su totalidad. "Antes de este estudio, sabíamos que esta danza molecular estaba sucediendo, pero nunca habíamos visto el baile en acción ", dice." Pero ahora que tenemos una estructura para RNR en su estado activo, tenemos una idea mucho mejor sobre cómo se mueven e interactúan los diferentes componentes de la enzima para transferir el radical a largas distancias ".
Aunque esta danza molecular une las subunidades, todavía hay una distancia considerable entre ellos:el radical debe viajar 35-40 angstroms desde la primera subunidad a la segunda. Este viaje es aproximadamente 10 veces más largo que la transferencia de radicales promedio, según Drennan. Luego, el radical debe viajar de regreso a su lugar de partida y almacenarse de manera segura, todo en una fracción de segundo antes de que la enzima vuelva a su conformación normal.
Dado que la RNR es un objetivo de los medicamentos que tratan el cáncer y ciertos virus, conocer su estructura de estado activo podría ayudar a los investigadores a diseñar tratamientos más efectivos. Comprender el estado activo de la enzima también podría proporcionar información sobre el transporte biológico de electrones para aplicaciones como los biocombustibles. Drennan y Kang esperan que su estudio anime a otros a capturar eventos celulares fugaces que han sido difíciles de observar en el pasado.
"Es posible que necesitemos reevaluar décadas de resultados pasados, "Drennan dice." Este estudio podría abrir más preguntas de las que responde; es más un principio que un final ".
Esta historia se vuelve a publicar por cortesía de MIT News (web.mit.edu/newsoffice/), un sitio popular que cubre noticias sobre la investigación del MIT, innovación y docencia.