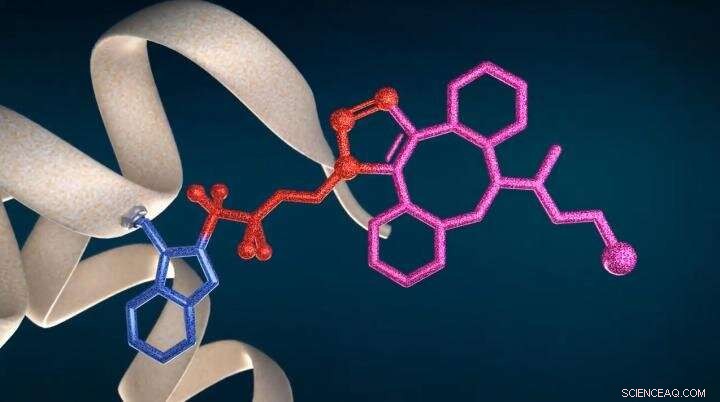
Nueva tecnología CF LINK para la bioconjugación de proteínas y la proteómica estructural Crédito:IOCB Praga (Fuente:youtu.be/a9IMvKv0UQU)
Investigadores de la Academia Checa de Ciencias y la start-up CF Plus Chemicals, con sede en Brno, una escisión de ETH Zurich, ha informado de una nueva tecnología llamada CF LINK para la bioconjugación selectiva de sitios de proteínas y su caracterización estructural. La tecnología puede preparar selectivamente conjugados de proteínas a través de sus residuos de triptófano y realizar modificaciones postraduccionales de aminoácidos aromáticos. Es más, También se puede utilizar como herramienta para el mapeo de superficies de proteínas y estudios de interacciones proteína-proteína.
La empresa CF Plus Chemicals, una spin-off de ETH Zurich fundada en 2014, se basa en casi 10 años de cooperación del grupo del Dr. Petr Beier en el Instituto de Química Orgánica y Bioquímica de la Academia Checa de Ciencias (IOCB Praga) y el Dr. Václav Matoušek, un doctorado ex alumno del Prof. Dr. Antonio Togni en ETH Zurich.
Reactivos basados en compuestos cíclicos hipervalentes de yodo-perfluoroalquilo, también llamados reactivos de Togni, se han convertido en herramientas muy utilizadas y populares en síntesis orgánica, especialmente en química médica para la preparación de nuevos candidatos a fármacos fluorados, en consonancia con la creciente demanda de andamios fluorados en el diseño de fármacos. A principios de la década de 1990, las moléculas fluoradas representaron el 5 por ciento del número total de medicamentos aprobados; ahora comprenden el 15 por ciento, y aproximadamente el 30 por ciento para terapias recientemente aprobadas.
Esta familia de compuestos químicos se expandió posteriormente en 2013 en colaboración de ETH Zurich y el Dr. Petr Beier de IOCB a una nueva generación de reactivos Togni patentados que llevan un grupo RCF2CF2 más complejo en lugar de un grupo CF3 simple. La nueva familia de estos productos químicos comparte no solo la rica reactividad de la primera generación de reactivos de Togni, pero también exhiben una variabilidad estructural virtualmente ilimitada del grupo tetrafluoroetilo sustituido en β, que pueden transferir a una variedad de sustratos relevantes para la química médica de moléculas pequeñas.
En 2017, el potencial de aplicación de la segunda generación de reactivos de Togni se amplió a las proteínas. Su alta afinidad hacia el grupo tiol permite la bioconjugación selectiva a través de cisteínas para formar conjugados estables que, a diferencia de los conjugados de maleimida, no están sujetos a una desconjugación lenta y al intercambio de tiol.
La presente invención se basa en el conocimiento previo de la naturaleza radical de las reacciones mediadas por reactivo de Togni. En el proyecto SME Instrument Horizon 2020, con el apoyo de la ciudad de Brno y en cooperación con el IOCB y el Dr. Petr Novák del Instituto de Microbiología de la Academia Checa de Ciencias (IMIC), se mostró que los reactivos de Togni, cuando se mezcla con ascorbato de sodio, un barato, agente reductor no tóxico y biocompatible, generar inmediatamente radicales tetrafluoroetilo sustituidos en ß que se unen selectivamente a residuos de triptófano estéricamente accesibles de la proteína en condiciones libres de metales de transición.
Una vez que los grupos azidofluoroalquilo se unen a la proteína, varios grupos funcionales, como tintes fluorescentes, Los radionúclidos o las toxinas ADC para la oncoterapia dirigida pueden unirse posteriormente mediante una reacción de clic para producir los correspondientes conjugados de proteínas. El método de bioconjugación selectivo de triptófano descrito no altera los puentes de disulfuro de proteínas y ofrece una solución alternativa donde la conjugación de cisteína convencional no es posible. por ejemplo, debido a una indeseable mezcla de disulfuro.
Este método de bioconjugación también puede extenderse a otros aminoácidos aromáticos y, por tanto, a proteínas que carecen de triptófano. Por lo tanto, fue posible modificar con éxito la insulina recombinante humana y unir hasta siete modificaciones a sus aminoácidos aromáticos, demostrando el potencial de modificación postraduccional de proteínas.
La naturaleza extremadamente rápida de esta reacción dirigida a los aminoácidos aromáticos accesibles a los disolventes la convierte en una herramienta conveniente para mapear las superficies de las proteínas y estudiar las interacciones proteína-proteína. Usando el ejemplo de la anhidrasa de carbono humana, los investigadores demostraron que los resultados del mapeo de la superficie están en excelente acuerdo con su estructura nativa publicada.
Prof. Dr. Martin Fusek, CEO de IOCB Tech, dice, "La base de los resultados comerciales exitosos de los resultados de la investigación básica es un excelente trabajo científico. Este es un resultado importante que no solo es útil como herramienta para la investigación básica, sino también como un medio para el desarrollo de nuevos medicamentos basados en proteínas. La singularidad, que debería ser más bien la regla, es que el proyecto fue creado por la cooperación de dos instituciones académicas y una empresa comercial. Estoy muy contento de que pudiéramos haber sido parte del proceso ".
Dr. Petr Beier, jefe de un grupo de investigación en IOCB Praga, dice, "Me alegra que hayamos podido desarrollar una colaboración interdisciplinaria exitosa de síntesis orgánica y bioquímica. Resulta que las propiedades específicas de los compuestos fluorados pueden utilizarse no solo tradicionalmente en la química médica de moléculas pequeñas, pero como se mostró recientemente también para la bioconjugación de proteínas y estudios de su estructura. Creo que en el futuro podremos identificar otros usos atractivos de los reactivos de Togni en bioquímica ".
Dr. Petr Novák, jefe de un grupo de investigación en IMIC, dice, "Gracias a los reactivos de Togni, hemos podido introducir una sonda fluorada en la estructura de la proteína en un entorno acuoso en cuestión de segundos. Ahora podemos utilizar esta tecnología para etiquetar de forma selectiva proteínas para el diagnóstico clínico o utilizarla para identificar la interfaz de interacción de las proteínas con sus ligandos ".
Dr. Václav Matoušek, CEO de CF Plus Chemicals, dice, "Estoy emocionado de ver que la reactividad de los reactivos de Togni podría extenderse a los aminoácidos aromáticos y aromáticos en general, abriendo así una plétora de aplicaciones potenciales, especialmente en la ciencia de las proteínas y la terapéutica basada en proteínas. Ahora estamos buscando activamente socios industriales establecidos que puedan aplicar nuestra tecnología para resolver sus desafíos ".