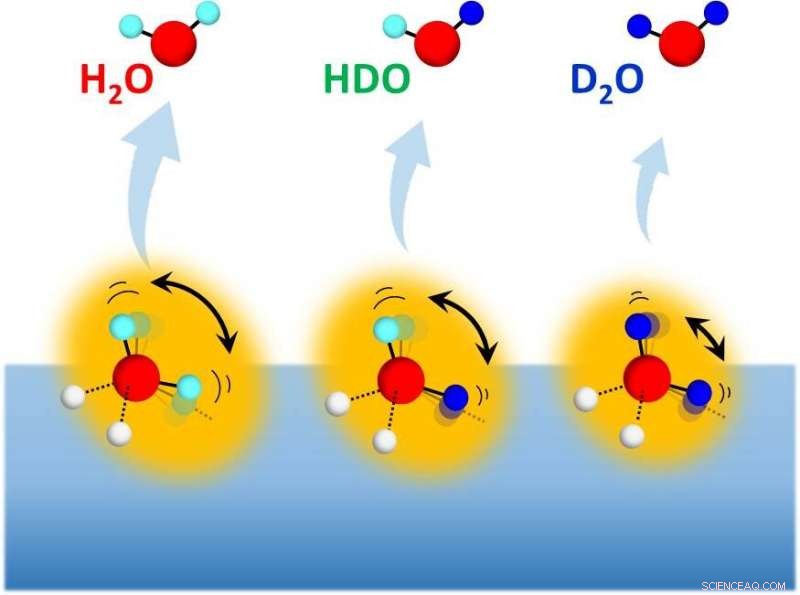
Desorción de isotopómeros de agua (H 2 Oh HDO y D 2 O) de superficies de hielo mezclado con isótopos con diversas composiciones H / D. Crédito:NINS / IMS
La naturaleza cuántica de los enlaces de hidrógeno en el agua se manifiesta en efectos isótopos fisicoquímicos peculiares:mientras que la deuteración a menudo alarga y debilita los enlaces de hidrógeno de los sistemas típicos de enlaces de hidrógeno compuestos por moléculas constituyentes voluminosas, alarga pero fortalece los enlaces de hidrógeno de los agregados moleculares de agua. El origen de este efecto isotópico único de las moléculas de agua queda por dilucidar a nivel molecular. Un estudio experimental reciente sobre la sublimación del hielo de agua mezclado con isótopos ha abordado este problema.
Las propiedades fisicoquímicas y biológicas de los sistemas con enlaces de hidrógeno se ven significativamente afectadas por los efectos cuánticos nucleares, incluidas las energías de punto cero de los modos vibracionales, deslocalización de protones, y efecto tunel. Estos se originan a partir de la masa nuclear extremadamente baja de hidrógeno; por lo tanto, Los sistemas con enlaces de hidrógeno muestran notables efectos isotópicos sobre la deuteración. En la década de 1930, Ubbelohde propuso por primera vez que la deuteración alarga y debilita los enlaces de hidrógeno en muchos sistemas con enlaces de hidrógeno. Desde entonces, tal efecto isotópico ha sido ampliamente confirmado y hoy en día es bien conocido como efecto Ubbelohde. A diferencia de, la dilución de las moléculas de agua en agua líquida y hielo se alarga pero fortalece los enlaces de hidrógeno. A pesar de intensos estudios experimentales y teóricos en más de tres cuartos de siglo, El origen a nivel molecular de este peculiar efecto isotópico sobre los enlaces de hidrógeno del agua no ha sido claro.
Recientemente, investigadores dirigidos por Toshiki Sugimoto, profesor asociado del Instituto de Ciencias Moleculares, han abordado el misterio de larga data:¿Cómo se pueden 2 Los agregados de O forman enlaces de hidrógeno más fuertes que el H 2 O agregados, en contraste con los sistemas de enlaces de hidrógeno compuestos por moléculas constituyentes voluminosas? Mediante mediciones selectivas de isótopos por sublimación de hielo mezclado con isótopos con diversas composiciones isotópicas H / D, los investigadores han hecho un nuevo descubrimiento para desentrañar el misterio; el efecto isotópico sobre la fuerza de los enlaces de hidrógeno se rige por dos efectos de deuteración:(1) el efecto de fortalecimiento del enlace derivado de la energía de punto cero del movimiento de rotación impedido, y (2) el efecto de debilitamiento (y alargamiento) de enlace derivado del acoplamiento anarmónico cuántico entre modos inter e intramoleculares.
El concepto más importante es que el efecto deuteración (1) derivado del movimiento de rotación juega un papel crucial en el proceso de ruptura de enlaces de moléculas extremadamente pequeñas y ligeras. En el caso de agregados de agua, La enorme diferencia isotópica en la energía del punto cero de la rotación obstaculizada pone de manifiesto una naturaleza peculiar del efecto de fortalecimiento de enlaces (1) abrumador sobre el efecto de debilitamiento de enlaces (2), que conduce al efecto isotópico único:las moléculas de agua deuteradas forman enlaces de hidrógeno más largos pero más fuertes que las moléculas de agua hidrogenada. A diferencia de, en el caso de otros sistemas típicos con enlaces de hidrógeno compuestos por moléculas constituyentes más grandes y pesadas, como el ácido oxálico dihidrato, ácido benzoico, ácido succínico, y ciclohexano / Rh (111), las diferencias isotópicas en la energía del punto cero de la rotación obstaculizada son insignificantes. Por lo tanto, solo el efecto de debilitamiento de enlaces (2) es predominante en el efecto isotópico sobre su energía de enlace, resultando en enlaces de hidrógeno más largos y más débiles en los sistemas deuterados que en los sistemas hidrogenados. Por lo tanto, las diferencias isotópicas en la fuerza de los enlaces de hidrógeno están determinadas por un delicado equilibrio entre los dos efectos de deuteración en competencia (1) y (2), mientras que aquellos en la longitud del enlace de hidrógeno, es decir, efecto isotópico geométrico, están básicamente dominados por el efecto deuteración (2).
"Estos resultados y conceptos proporcionan una nueva base para nuestra comprensión fundamental de los enlaces de hidrógeno del agua altamente cuánticos, "dice Sugimoto.