Crédito:Universidad de Manchester
Trabajo liderado por el grupo de investigación del profesor Steve Liddle y publicado en la prestigiosa revista Química de la naturaleza ha informado de una molécula de dinitrógeno de uranio que, según la teoría química básica, no debería existir. La molécula que rompe las reglas podría tener implicaciones para la activación del dinitrógeno, que es una molécula esencial para la producción de fertilizantes.
Aproximadamente 450 millones de toneladas de fertilizantes se producen cada año utilizando amoníaco obtenido del proceso de Haber Bosch, y este es el fertilizante que sustenta la vida en la Tierra. En Haber Bosch, El dinitrógeno se une a los metales en la superficie del catalizador y se divide. Luego reacciona con dihidrógeno para producir amoníaco.
Dada la gran escala en la que opera Haber Bosh, Durante muchos años ha habido interés en cómo el dinitrógeno se une a los metales de la tabla periódica en complejos moleculares, ya que estas especies se pueden estudiar en detalle atómico, porque esto nos informa sobre los pasos clave de unión y división en Haber Bosch. Esto explica la mayor parte de las demandas energéticas de este proceso.
Uno de los secretos mejor guardados de Haber Bosch es que, aunque el hierro es el catalizador de elección, De hecho, el uranio es un catalizador superior, por lo que existe interés en cómo se une el uranio al dinitrógeno.
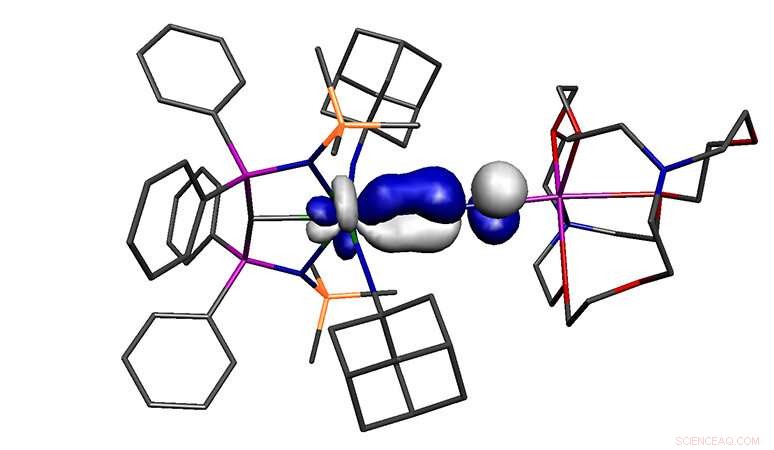
El dinitrógeno es aparentemente una de las peores moléculas para unirse a los metales. En efecto, es tan inerte que generalmente se usa como atmósfera protectora para síntesis químicas, y en envases de alimentos para evitar que los alimentos se salgan. Sin embargo, en determinadas circunstancias, se puede fomentar la unión de dinitrógeno a metales, y en este modelo, el metal debe estar en un estado de oxidación bajo y ser lo suficientemente rico en electrones para participar en la unión, por lo que el dinitrógeno dona densidad de electrones al metal y el metal se mueve alternativamente.
De ello se deduce que un metal con un estado de oxidación alto y un metal pobre en electrones no debería poder participar en este modelo de enlace porque no debería poder participar en la parte recíproca del enlace.
La molécula reportada en el estudio es un estado de oxidación alto, metal pobre en electrones, sin embargo, se une al dinitrógeno, uno de los peores ligandos posibles. Por lo tanto, la molécula no debería existir, sin embargo, lo hace. La hipótesis de trabajo de por qué se puede formar la molécula es que el uranio está unido a tres ligandos donantes extremadamente fuertes, y a pesar de su alto estado de oxidación, estos tres ligandos hacen que el uranio sea inusualmente rico en electrones en general, y esto anula las restricciones habituales sobre el modelo de vinculación.
Este trabajo reescribe una regla fundamental de la química, y puede tener implicaciones más amplias, porque gran parte de la química de activación del dinitrógeno se basa en la suposición de que se necesitan metales de bajo estado de oxidación. Sin embargo, este estudio ahora muestra que los metales en alto estado de oxidación, en las circunstancias adecuadas, también podría apoyar la nueva química de activación de dinitrógeno.
Este conocimiento permitirá a los científicos pensar de manera diferente sobre cómo abordar los desafíos de la activación del dinitrógeno, e incluso podría influir en los estudios del proceso de Haber Bosch.