La ingeniería intracelular puede ser una herramienta poderosa para sintetizar cristales de proteínas funcionales con propiedades catalíticas prometedoras, según muestran investigadores de Tokyo Tech. Utilizando bacterias genéticamente modificadas como plataforma de síntesis respetuosa con el medio ambiente, los investigadores produjeron catalizadores sólidos híbridos para la fotosíntesis artificial. Estos catalizadores exhiben alta actividad, estabilidad y durabilidad, lo que destaca el potencial del enfoque innovador propuesto.
Los cristales de proteínas, al igual que los cristales normales, son estructuras moleculares bien ordenadas con diversas propiedades y un enorme potencial de personalización. Pueden ensamblarse de forma natural a partir de materiales que se encuentran dentro de las células, lo que no sólo reduce en gran medida los costos de síntesis sino que también disminuye su impacto ambiental.
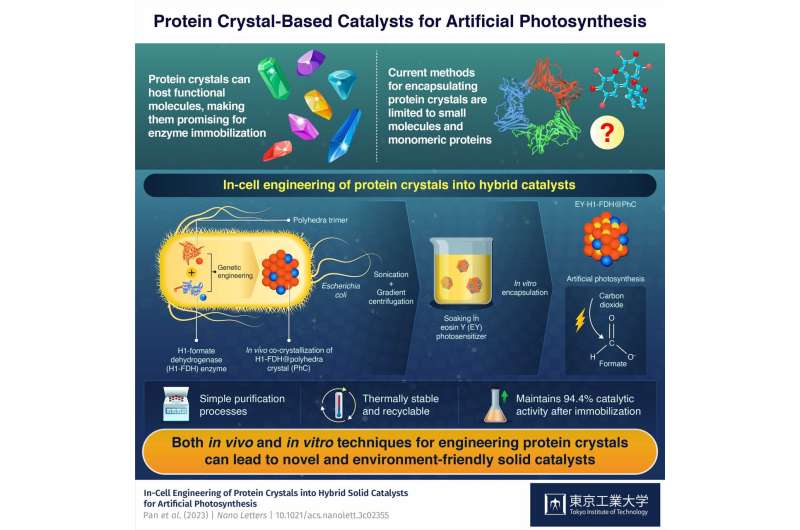
Aunque los cristales de proteínas son prometedores como catalizadores porque pueden albergar varias moléculas funcionales, las técnicas actuales sólo permiten la unión de moléculas pequeñas y proteínas simples. Por lo tanto, es imperativo encontrar formas de producir cristales de proteínas que contengan enzimas naturales y moléculas funcionales sintéticas para aprovechar todo su potencial de inmovilización de enzimas.
En este contexto, un equipo de investigadores del Instituto Tecnológico de Tokio (Tokyo Tech), dirigido por el profesor Takafumi Ueno, ha desarrollado una estrategia innovadora para producir catalizadores sólidos híbridos basados en cristales de proteínas. Como se explica en su artículo publicado en Nano Letters El 12 de julio de 2023, su enfoque combina ingeniería interna y un proceso in vitro simple para producir catalizadores para la fotosíntesis artificial.
El componente básico del catalizador híbrido es un monómero proteico derivado de un virus que infecta al gusano de seda Bombyx mori. Los investigadores introdujeron el gen que codifica esta proteína en la bacteria Escherichia coli, donde los monómeros producidos formaron trímeros que, a su vez, se ensamblaron espontáneamente en cristales poliedros estables (PhC) uniéndose entre sí a través de su hélice α N-terminal (H1). ).
Además, los investigadores introdujeron una versión modificada del gen de la formiato deshidrogenasa (FDH) de una especie de levadura en el genoma de E. coli. Este gen hizo que las bacterias produjeran enzimas FDH con terminales H1, lo que llevó a la formación de cristales híbridos H1-FDH@PhC dentro de las células.
El equipo extrajo los cristales híbridos de la bacteria E. coli mediante sonicación y centrifugación en gradiente, y los sumergió en una solución que contenía un fotosensibilizador artificial llamado eosina Y (EY). Como resultado, los monómeros proteicos, que habían sido modificados genéticamente de manera que su canal central pudiera albergar una molécula de eosina Y, facilitaron la unión estable de EY al cristal híbrido en grandes cantidades.
A través de este ingenioso proceso, el equipo logró producir catalizadores EY·H1-FDH@PhC altamente activos, reciclables y térmicamente estables que pueden convertir dióxido de carbono (CO2 ) en formato (HCOO − ) tras la exposición a la luz, imitando la fotosíntesis. Además, mantuvieron el 94,4% de su actividad catalítica tras la inmovilización en comparación con la de la enzima libre.
"La eficiencia de conversión del cristal híbrido propuesto fue un orden de magnitud mayor que la de los compuestos previamente informados para la fotosíntesis artificial enzimática basada en FDH", dice el profesor Ueno. "Además, el PhC híbrido permaneció en el estado de ensamblaje de proteína sólida después de soportar procesos de ingeniería tanto in vivo como in vitro, lo que demuestra la notable capacidad de cristalización y la fuerte plasticidad de los PhC como andamios encapsulantes".
En general, este estudio muestra el potencial de la bioingeniería para facilitar la síntesis de materiales funcionales complejos. "La combinación de técnicas in vivo e in vitro para la encapsulación de cristales de proteínas probablemente proporcionará una estrategia eficaz y respetuosa con el medio ambiente para la investigación en las áreas de nanomateriales y fotosíntesis artificial", concluye el profesor Ueno.
Más información: Tiezheng Pan et al, Ingeniería intracelular de cristales de proteínas en catalizadores sólidos híbridos para la fotosíntesis artificial, Nano Letters (2023). DOI:10.1021/acs.nanolett.3c02355
Información de la revista: Nanoletras
Proporcionado por el Instituto de Tecnología de Tokio