Las nanopinzas optotérmicas son un método de diseño óptico innovador que ha revolucionado las técnicas ópticas clásicas para capturar una amplia gama de nanopartículas. Si bien el campo de temperatura optotérmica se puede emplear para la regulación in situ de nanopartículas, persisten desafíos para identificar su potencial para regular las bionanopartículas.
Para observar los efectos sinérgicos de la manipulación optotérmica y la biodetección basada en repeticiones palindrómicas cortas agrupadas regularmente interespaciadas (CRISPR), los investigadores desarrollaron una combinación de nanopinzas optotérmicas impulsadas por CRISPR abreviadas como CRONT.
En un nuevo informe en Light:Science &Applications , Jiajie Chen y un equipo de investigación en ingeniería optoelectrónica, ingeniería biomédica y física, lograron esto aprovechando la difusioforesis y los flujos termoosmóticos para la excitación optotérmica mediante el enriquecimiento exitoso de nanopartículas de oro funcionalizadas con ADN, proteínas asociadas a CRISPR y cadenas de ADN.
Los científicos se basaron en un esquema optotérmico para mejorar la detección de polimorfismos de un solo nucleótido asociado a CRISPR a nivel de molécula única, para introducir un nuevo método basado en CRISPR para observar la escisión de nucleótidos. Los investigadores estudiaron este enfoque innovador como un campo universal de diagnóstico en el punto de atención, biofotónica y bionanotecnología.
En 1986, Arthur Ashkin inventó unas pinzas ópticas para regular nanoobjetos de forma remota y recibió el Premio Nobel de Física en 2018 por este descubrimiento pionero y su contribución a los sistemas biológicos. Mientras que las pinzas ópticas clásicas dependen de la transformación del impulso de la luz, las combinaciones interdisciplinarias entre óptica plasmónica, campo eléctrico y temperatura han abordado eficazmente los límites.
Ha surgido una variedad de enfoques innovadores para ofrecer nuevas oportunidades en el análisis y la regulación de partículas. Las nanopinzas optotérmicas utilizan fuerzas termodinámicas inducidas ópticamente para regular las nanopartículas en la escala micrométrica con una precisión submicrónica.
En comparación con las pinzas ópticas tradicionales, las pinzas optotérmicas requieren una menor densidad de potencia, lo que las convierte en una alternativa atractiva para la detección biológica y, al mismo tiempo, reduce los efectos ópticos adversos en las muestras biológicas. Dado que los efectos térmicos desempeñan un papel clave durante una variedad de procesos biológicos, es posible aprovechar las capacidades del campo de temperatura para aplicaciones prácticas.
El método se puede utilizar para regular bionanopartículas que van desde la escala micro a la nanoescala para incluir bacterias y células vivas, así como moléculas y proteínas de ADN monocatenario y bicatenario.
Combinando CRISPR con nanopinzas:CRONT
El sistema de repetición de palíndromo corto agrupado y regularmente interespaciado (CRISPR) ofrece en sí mismo una notable herramienta de edición de genes, que también recibió un premio Nobel en 2020. El método comprendía una proteína nucleasa asociada a CRISPR y un ARN guía específico del ADN objetivo.
Los biofísicos y bioingenieros están cada vez más interesados en mejorar la sensibilidad y versatilidad de la detección de ADN combinando el sistema CRISPR-Cas con nuevos modos de detección.
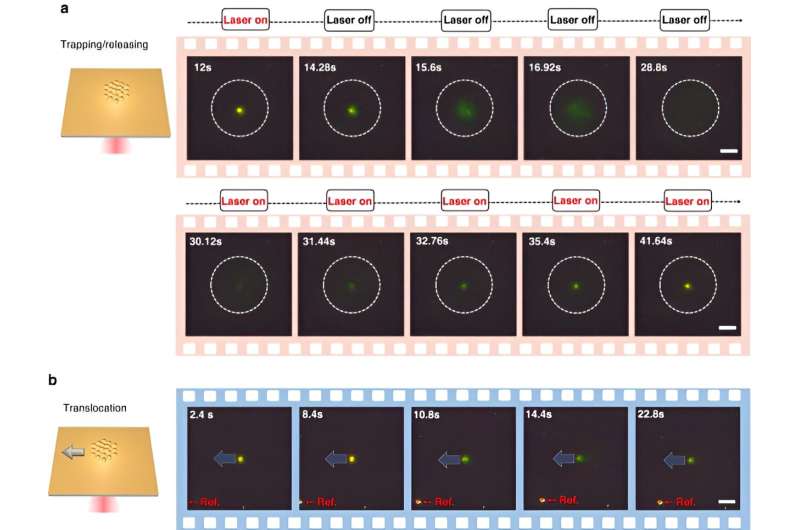
Para superar los límites existentes del método, Chen y sus colegas diseñaron una plataforma de pinzas optotérmicas de aplicación universal conocida como nanopinzas optotérmicas impulsadas por CRISPR para identificar bionanopartículas y utilizaron la configuración para identificar moléculas de ADN in situ, sin amplificación de ácido nucleico. Los experimentos proporcionaron volúmenes de detección ultrabajos de 10 μL para identificar polimorfismos de un solo nucleótido para estudiar la diversidad genética, la susceptibilidad a enfermedades y la respuesta a los medicamentos, para satisfacer las demandas futuras de la investigación y la medicina genómica.
Para habilitar CRONT (nanopinzas optotérmicas impulsadas por CRISPR), los científicos diseñaron una cámara de microfluidos con una fina capa de película de oro depositada sobre el cubreobjetos. Cuando el equipo irradió la película de oro con iluminación láser, generaron un campo de temperatura que rodeaba el punto láser. Los científicos detallaron las condiciones óptimas de las reacciones CRISPR e iniciaron la escisión del conjugado de nanopelícula de oro y ADN mediante microscopía de campo oscuro.
Agregaron un polímero no iónico de polietilenglicol (PEG) a la solución acuosa como tensioactivo biológico para una excelente biocompatibilidad.
La presencia de múltiples nanopartículas y su movilidad termoforética variable generó una concentración de soluto distinta. Cuando los solutos con concentraciones elevadas influyeron en aquellos con concentraciones más bajas a través de la presión osmótica, los resultados dieron como resultado una interacción conocida como fuerza difusioforética. Esta investigación sistemática destacó el potencial de incluir CRONT para realizar la identificación biomolecular.
Combinación optotérmica de proteínas y ADN
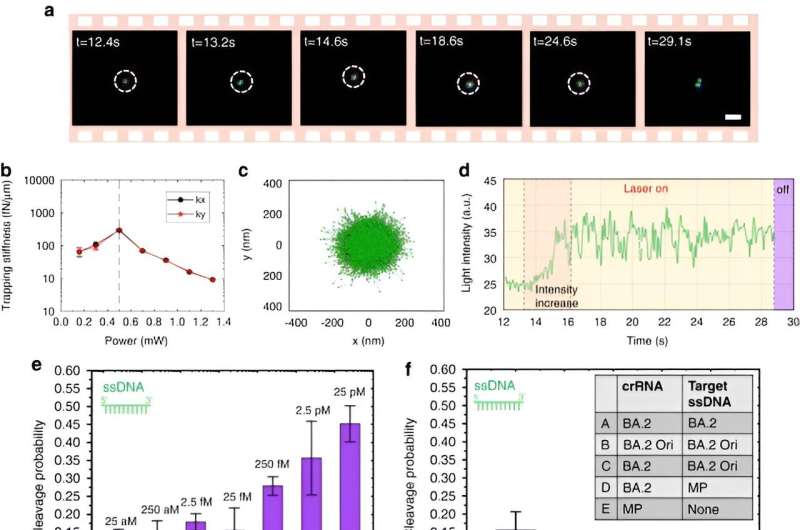
Para habilitar las nanopinzas optotérmicas impulsadas por CRISPR, Chen y sus colegas estudiaron los comportamientos de agregación de proteínas y ADN mediante el uso de etiquetado fluorescente donde la longitud del tallo rígido generaba un gradiente de concentración de polietilenglicol. Si bien una mayor potencia del láser no aumentó continuamente la tasa de acumulación debido a un flujo termoosmótico ampliado, la acumulación de ADN monocatenario fue mayor que la del ADN bicatenario. Si bien las acumulaciones de proteínas rara vez se estudian en biofísica, las proteínas Cas12a marcadas con fluorescencia mostraron una tendencia a formar ligeras acumulaciones en forma de anillos, donde el aumento de la potencia del láser aumentaba su tasa de acumulación.
El equipo también realizó experimentos con proteínas comúnmente incorporadas, como la albúmina sérica bovina con etiquetado FITC. En presencia de un campo optotérmico, esta distribución de proteínas permaneció aleatoria y no se vio afectada por la presencia de moléculas de polietilenglicol.
Chen y su equipo notaron cómo el campo optotérmico asociado con las nanopinzas optotérmicas (CRONT) impulsadas por CRISPR, proporcionaba una temperatura adecuada para la biodetección basada en CRISPR, con la capacidad de enriquecer bionanopartículas para detectar ADN en concentraciones ultrabajas, en lugar del movimiento browniano solo, que es gobernado a través de la detección de difusión.
Los científicos incluyeron el esquema CRISPR-12a para examinar el ADN ambiental monocatenario. El sistema CRONT identificó con éxito ADN a nivel de molécula única para polimorfismos de un solo nucleótido con alta sensibilidad y especificidad.
De esta manera, Jiajie Chen y sus colegas incorporaron difusioforesis y flujos termoosmóticos en la capa límite de una película sensible optotérmica para mostrar un nuevo método para regular las nanopinzas optotérmicas impulsadas por CRISPR a nanoescala.
Este método permitió la implementación inmediata de biodetección basada en CRISPR con un volumen de detección ultrabajo.
Las pinzas ópticas están dotadas de identificación de ADN a través de sistemas de biodetección basados en CRISPR como una vía para el enriquecimiento de biomoléculas para escindir el complejo CRISPR. Estas nanopinzas optotérmicas impulsadas por CRISPR o sistemas CRONT son inmensamente prometedores para avanzar en la comprensión de procesos biológicos complejos como una sonda de detección versátil en la investigación biomédica, el descubrimiento de fármacos y el diagnóstico de enfermedades.
Más información: Jiajie Chen et al, Nanopinzas optotérmicas impulsadas por CRISPR:manipulación diversa de bionanopartículas e identificación de un solo nucleótido, Luz:ciencia y aplicaciones (2023). DOI:10.1038/s41377-023-01326-9
Información de la revista: Luz:ciencia y aplicaciones
© 2023 Red Ciencia X