En un estudio publicado en Clinical and Translational Medicine , un grupo de investigación de la Universidad de Nanjing evaluó los efectos dentro y fuera del objetivo del sistema de administración de ARNip autoensamblado.
La terapia de interferencia de ARN (ARNi) implica la administración de pequeños ARN de interferencia (ARNip) a las células diana para provocar efectos terapéuticos. Aunque el ARNip exhibe una unión específica al gen diana para lograr efectos en el objetivo, también puede interactuar con genes que no son el objetivo, lo que produce efectos fuera del objetivo. Por lo tanto, uno de los desafíos clave en la terapia con ARNi radica en lograr un equilibrio entre los efectos dentro y fuera del objetivo para mejorar el impacto deseado en el objetivo y al mismo tiempo minimizar el riesgo fuera del objetivo asociado.
El grupo de investigación de la Universidad de Nanjing, formado por Chen-Yu Zhang y Xi Chen, desarrolló un enfoque único de administración de ARNip reprogramando el hígado del huésped para sintetizar ARNip autoensamblados encapsulados dentro de pequeñas vesículas extracelulares (sEV) para su entrega a tejidos específicos para tratar diversas enfermedades.
En este estudio, los autores investigaron más a fondo los efectos dentro y fuera del objetivo del sistema de administración de ARNip autoensamblado, abordando los desafíos de la administración de ARNip in vivo y destacando su potencial terapéutico y su bioseguridad. Destacaron la potencia superior de los ARNip autoensamblados para silenciar objetivos específicos en comparación con los ARNip sintéticos.
El análisis transcriptómico confirmó además efectos mínimos fuera del objetivo en tejidos normales y efectos anti-EGFR significativos en células tumorales in vivo. En general, el estudio proporciona información prometedora sobre la eficacia terapéutica y los efectos secundarios del sistema de administración de ARNip autoensamblado in vivo.
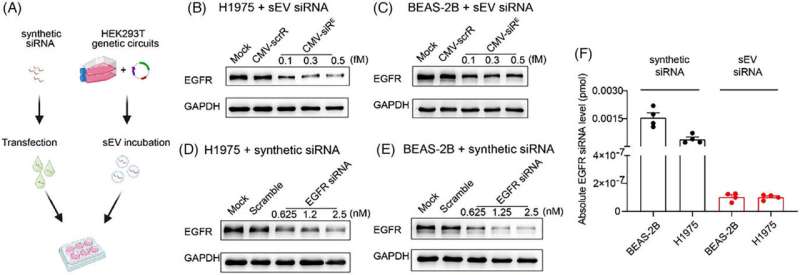
Este estudio ha revelado la impresionante eficacia del ARNip autoensamblado encapsulado en sEV, que exhibió una potente interferencia en la proteína EGFR con solo 1/2.000.000 de la cantidad de transfección sintética. Esta revelación indica que los ARNip encapsulados en sEV procesados endógenamente funcionan perfectamente dentro de las células receptoras a niveles fisiológicos, mientras que la acumulación de niveles suprafisiológicos de ARNip sintéticos en células normales puede causar citotoxicidad.
Por lo tanto, la estrategia de administración de ARNip autoensamblado in vivo no solo es eficaz a una concentración de ARNip bastante baja en células tumorales, sino que también presenta una mayor bioseguridad para las células somáticas que los ARNip sintéticos.
La actividad fuera del objetivo de los ARNip puede provocar fenotipos imprevistos y comprometer las ventajas terapéuticas de los ARNip. Este estudio evaluó meticulosamente los riesgos no deseados de los ARNip de EGFR autoensamblados in vivo mediante secuenciación transcriptómica.
No se observó en tejidos normales un enriquecimiento estadísticamente significativo para coincidencias perfectas entre la región semilla de ARNip de EGFR y las 3'-UTR de transcripciones reguladas negativamente. En el tejido tumoral, el análisis de enriquecimiento de ontología genética (GO) reveló que la mayoría de los principales términos GO estaban estrechamente asociados con la señalización de EGFR. Los datos indican que los efectos fuera del objetivo en los tejidos normales son mínimos en comparación con los efectos en el objetivo observados en las células tumorales.
En cuanto a los riesgos potenciales asociados con la saturación de la maquinaria de miARN endógeno por ARNip exógenos, el análisis de los genes diana de miR-122 después del tratamiento con ARNip autoensamblado in vivo reveló solo 13 cambios significativos entre 1566 objetivos potenciales.
La mayoría de los objetivos de miR-122 mostraron patrones de expresión similares en comparación con el grupo no tratado. Estos datos indican que los ARNip de EGFR autoensamblados in vivo están presentes en niveles fisiológicos apropiados y tienen pocas posibilidades de causar hepatotoxicidad a través de perturbaciones en las vías intrínsecas de los miARN.
En general, este estudio marca una dirección novedosa para la terapia con ARNi y tiene implicaciones significativas para la adopción clínica del sistema de administración de ARNip autoensamblado in vivo.
A diferencia de la terapia génica convencional, este método demuestra una alta especificidad con riesgos mínimos fuera del objetivo y sin efectos secundarios tóxicos. Además, el estudio ofrece nuevos conocimientos para evaluar los efectos secundarios establecidos y no establecidos en el desarrollo de la terapia con ARNip in vivo para diversos genes.
Más información: Hongyuan Guo et al, Evaluación de los efectos dentro y fuera del objetivo del sistema de administración de ARN pequeño de interferencia del receptor del factor de crecimiento epidérmico autoensamblado, Medicina clínica y traslacional (2024). DOI:10.1002/ctm2.1579
Proporcionado por la Facultad de Ciencias de la Vida de la Universidad de Nanjing