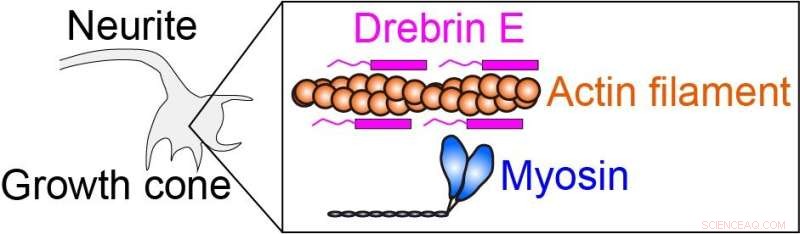
La fuerza intracelular es producida por la interacción de la miosina con el filamento de actina (filamento de proteína). Drebrin E puede inhibir la interacción actina-miosina, por lo tanto, regular la fuerza intracelular. Se sabe que la concentración de drebrina E disminuye durante el desarrollo animal. Sin embargo, la correlación entre la concentración de drebrina y la actividad de actina-miosina sigue sin estar clara, especialmente a la temperatura fisiológica. Crédito:Hiroaki Kubota et al.
Un grado centígrado puede marcar la diferencia:un equipo de investigadores dirigido por la Universidad de Osaka ha demostrado la regulación de un complejo proteico crítico que ocurre solo a temperatura fisiológica.
Para estudiar las funciones de las proteínas, los investigadores examinan las proteínas purificadas in vitro. Dichos experimentos generalmente se limitan a temperaturas por debajo de la temperatura fisiológica para evitar daños térmicos a las proteínas. El equipo ha superado este problema aplicando calentamiento controlado ópticamente con un láser infrarrojo pulsado. "Con este método, las proteínas se pueden calentar hasta 40 grados centígrados sin dañarlas", dice el autor principal Hiroaki Kubota, "lo que nos permite examinar cómo actúan las proteínas a su temperatura fisiológica".
Los investigadores aplicaron este método de calentamiento para estudiar el complejo de actomiosina. La generación de fuerza de actomiosina, que resulta de la interacción entre los motores moleculares de miosina y los filamentos de actina, es un proceso crucial que gobierna la motilidad y la morfología celular. Se ha demostrado que la proteína drebrina E inhibe estas interacciones, pero su mecanismo de regulación no está claro. Para aclarar el papel de la drebrina E, el equipo aplicó calentamiento microscópico a la actomiosina en presencia de drebrina y observó la motilidad producida por la generación de fuerza de la actomiosina en un rango que va desde la temperatura ambiente hasta la temperatura fisiológica.
Los investigadores encontraron que la inhibición de la motilidad de la actomiosina por drebrin E se elimina de forma inmediata y reversible durante el calentamiento, dependiendo de la concentración de drebrin E. A medida que aumenta la temperatura, disminuye la inhibición de la motilidad de la actomiosina por la drebrina E. El equipo también descubrió que la inhibición reducida no se debe únicamente a la disociación de la drebrina E de la actina. En cambio, la drebrina E unida regula cooperativamente la actividad de la actomiosina, probablemente al alterar la estructura de la actina.
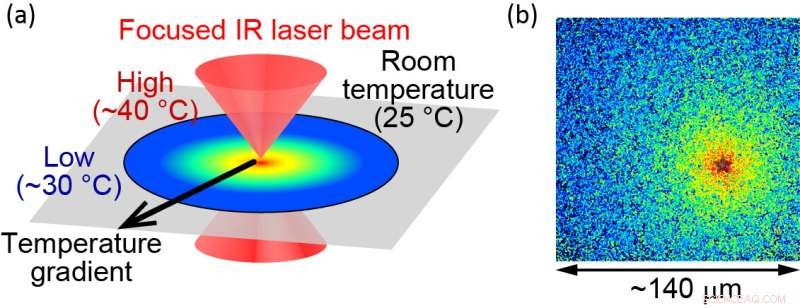
(a) Ilustración del método de calentamiento microscópico controlado ópticamente. (b) La temperatura localizada se visualiza utilizando moléculas fluorescentes. La fuente de calor se encuentra en la "estrella", donde la temperatura se mide en aproximadamente 40 °C. El final del campo de visión es de aproximadamente 30 °C. El tamaño del campo de visión es de aproximadamente 140 μm. Crédito:Hiroaki Kubota et al.
Curiosamente, por debajo de la temperatura fisiológica, la motilidad de la actomiosina muestra una disminución gradual con el aumento de la concentración de drebrina E. Sin embargo, a 36,5 grados centígrados a 37,5 grados centígrados, el comportamiento cambia y drebrin E exhibe un comportamiento de inhibición de tipo interruptor. La motilidad no se ve afectada por la concentración de drebrina E hasta que se alcanza un umbral, lo que da como resultado una inhibición inmediata. Sus hallazgos sugieren que la concentración umbral es similar a las concentraciones fisiológicas de drebrina E informadas anteriormente.
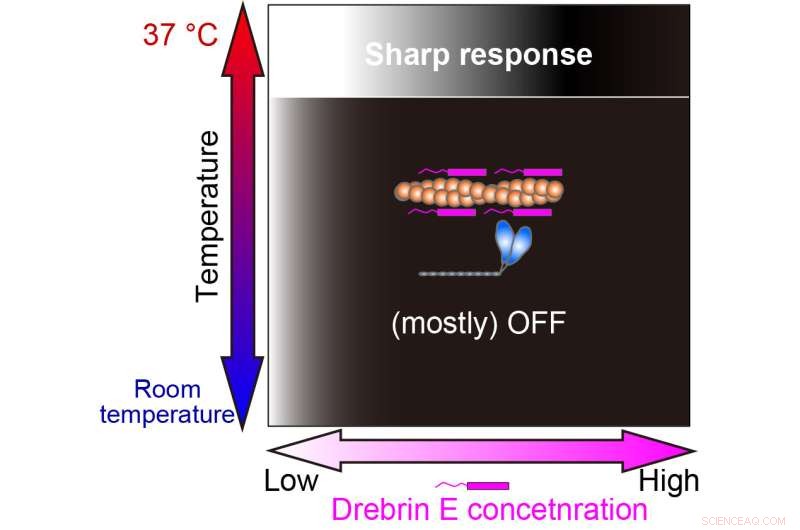
Nuestro estudio reveló que la regulación de la interacción actina-miosina por drebrin E es eficiente solo a la temperatura fisiológica (37°C). La gradación de blanco y negro representa la producción de fuerza On (blanco) y Off (negro). Crédito:Hiroaki Kubota et al.
Esta regulación dependiente de la temperatura de drebrin E es notable y tiene muchas implicaciones para estudios futuros. "Estos resultados sugieren la importancia de que los mamíferos preñados mantengan la temperatura corporal adecuada para garantizar el desarrollo preciso de un embrión", dice Madoka Suzuki, autora principal. Además, al obtener una comprensión precisa de los mecanismos de la maquinaria de detección de temperatura celular, podemos innovar en el desarrollo de sensores de temperatura artificiales a nanoescala.
El artículo, "El control microscópico de la temperatura revela la regulación cooperativa de la interacción actina-miosina por la drebrina E" se publicó en Nano Letters . Formación controlada de cicatrices en el cerebro