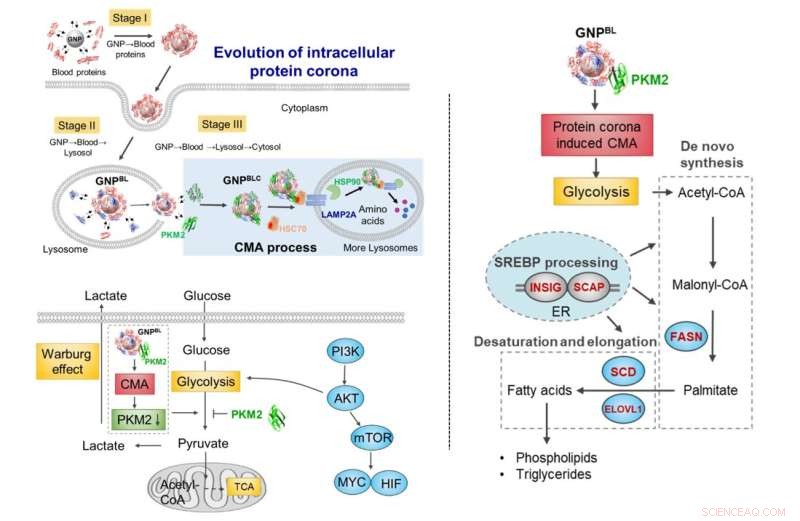
Evolución de la corona de nanoproteínas durante el transporte celular. Durante el transporte desde el citoplasma lisosomal de la sangre, el intercambio de componentes de la corona de proteínas con proteínas intracelulares (proteínas chaperonas, quinasas metabólicas) desencadena un aumento en la actividad de autofagia mediada por proteínas chaperonas y remodela selectivamente el metabolismo celular. Crédito:Chen Chunying y otros.
Un equipo de investigación dirigido por el Prof. Chen Chunying del Centro Nacional de Nanociencia y Tecnología (NCNST) de la Academia de Ciencias de China (CAS) investigó recientemente la evolución de la corona de nanoproteínas durante la endocitosis y su alteración de la homeostasis de proteínas y células. metabolismo. Sus resultados fueron publicados en PNAS .
Cuando las nanopartículas ingresan a los sistemas biológicos, las biomoléculas del fluido biológico se unen rápidamente a la superficie de las nanopartículas. La corona de nanoproteínas formada al interactuar con moléculas de proteínas en la sangre como un paso inicial tiene un gran impacto en el transporte y el destino de las nanopartículas. La forma en que la formación de la corona de nanoproteínas afecta el reconocimiento, el transporte, la distribución, la función y los efectos biológicos de las nanopartículas en los tejidos y las células de diferentes sistemas de barrera es una "caja negra" para la aplicación médica de los nanomateriales, que no solo restringe la entrega eficiencia de la nanomedicina, sino que también afecta gravemente a la eficacia y la seguridad.
Un desafío importante en esta área es la complejidad de la corona de nanoproteínas, que está influenciada por la diversidad de biomoléculas en diferentes tejidos y órganos, así como por estados fisiológicos y patológicos. En la actualidad, existe una necesidad urgente de comprender cómo evolucionan la composición proteica y las características estructurales de la corona de proteínas dentro de los microambientes biológicos.
Para resolver este problema, los investigadores han revelado el patrón de evolución dinámica de la composición proteica de la corona de nanoproteínas en el proceso de transporte celular mediante la aplicación innovadora de multiómica multidimensional (proteómica, metabolómica, lipidómica), interacciones intermoleculares , e imágenes de espectrometría de masas in situ.
Tomando nanopartículas de oro como modelo, se estudió el proceso de evolución dinámica de la proteína corona desde el sistema sanguíneo hasta el intracelular (sangre-lisosoma-citoplasma). Cuando las nanopartículas entraron por endocitosis en el lisosoma desde el entorno sanguíneo y luego escaparon del lisosoma al citoplasma, la composición de proteínas en la superficie de las nanopartículas cambiaría drásticamente. La mayoría fueron reemplazadas por moléculas de proteínas intracelulares, conservando solo una parte de los componentes de la corona de proteínas formados en el entorno sanguíneo.
Posteriormente, la evolución intracelular de la corona de nanoproteínas no solo interrumpió la homeostasis de proteínas intracelulares (proteostasis), sino que también desencadenó el enriquecimiento de proteínas chaperonas (HSC70, HSP90) y piruvato quinasa M2 (PKM2) en la superficie de la nanocorona intracelular. y estimuló la autofagia mediada por chaperonas. Afectó aún más la glucólisis celular, causando cambios en el metabolismo energético celular y regulando el proceso de metabolismo de los lípidos celulares.
Este estudio aclara el patrón evolutivo de las nanopartículas desde la sangre hasta un microambiente subcelular e identifica la especificidad del microambiente intracelular de la corona de nanoproteínas, remodelando así el metabolismo celular. También proporciona apoyo teórico para una comprensión profunda de los complejos efectos biológicos de los nanomateriales y la regulación de la interfaz nanobiótica. Los efectos de la proteína corona en las interacciones de los liposomas visualizados con AIE con ce