Gráficamente abstracto. Crédito:ACS Nano (2022). DOI:10.1021/acsnano.2c02709
El control del espín de los electrones abre escenarios futuros para aplicaciones en la electrónica basada en el espín (espintrónica), por ejemplo, en el procesamiento de datos. También presenta nuevas oportunidades para controlar la selectividad y la eficiencia de las reacciones químicas. Los investigadores presentaron recientemente los primeros éxitos con el ejemplo de la división del agua para producir hidrógeno y oxígeno "verdes". Un proyecto conjunto en el que participan grupos de trabajo del Center for Soft Nanoscience de la Universidad de Münster (Alemania) y del Instituto de Química de la Universidad de Pittsburgh (Pennsylvania; Prof. David Waldeck) ahora tiene la tarea de avanzar en el desarrollo sistemático del espín. -materiales catalizadores selectivos.
Con este fin, los investigadores relacionan la actividad catalítica de varios materiales polarizadores de espín inorgánicos con mediciones directas de la selectividad de espín. La atención se centra en los materiales de óxido que se cultivaron deliberadamente con una estructura quiral. Además, los investigadores también quieren investigar el origen de la polarización del espín en estos materiales quirales. Los resultados de un estudio inicial de capas de óxido de cobre quirales ahora se han publicado en ACS Nano diario.
Los resultados en breve
El equipo de investigadores alemanes y estadounidenses primero examinó los catalizadores de óxido quiral, que consisten en este caso en capas delgadas de óxido de cobre quiral sobre una película delgada de oro. Los datos medidos muestran que la polarización de espín de los electrones depende de cuál de estas capas provienen los electrones. El equipo considera que dos efectos son responsables de esto:el efecto de selectividad de espín inducida por quiralidad (CISS) y la disposición magnética en las capas quirales. Los resultados ayudarán en la producción futura de materiales de óxido catalítico de espín selectivo, mejorando así la eficiencia de las reacciones químicas.
El ejemplo de las pilas de combustible:el espín electrónico no deseado reduce la eficiencia
En las celdas de combustible, el hidrógeno y el oxígeno reaccionan entre sí y forman agua, y en el proceso se libera energía eléctrica. Es posible que el hidrógeno se haya producido previamente a través del proceso inverso, descomponiendo las moléculas de agua en hidrógeno y oxígeno. La energía necesaria para ello puede proporcionarse a través de energía eléctrica procedente de fuentes de energía regenerativas o directamente a través de la luz solar, por lo que, en el futuro, el hidrógeno podría servir como fuente de energía en un ciclo energético diseñado para ser CO2 -neutro.
Lo que está frenando cualquier comercialización a gran escala del concepto, por ejemplo, en vehículos eléctricos que funcionan con celdas de combustible, es, entre otras cosas, la baja eficiencia. Se tiene que usar mucha energía para descomponer las moléculas de agua, lo que significa que en la actualidad es menos costoso usar esta energía directamente para recargar la batería de un automóvil. Esta menor eficiencia en la descomposición de las moléculas de agua es consecuencia no solo de la alta sobretensión necesaria para generar oxígeno en el ánodo de la celda de electrólisis, sino también de la producción de subproductos no deseados, como el peróxido de hidrógeno y el oxígeno excitado electrónicamente. Debido a su alta reactividad, estos subproductos también pueden atacar el material del electrodo. Ambos subproductos se producen en el llamado estado singulete, en el que los espines de los electrones implicados en los enlaces moleculares se alinean en modo antiparalelo entre sí. En el producto deseado de la reacción (oxígeno en el estado fundamental electrónico), este no es el caso porque forma un estado triplete con espines alineados en paralelo y, por lo tanto, generar solo una dirección de espín ayuda a llegar a este estado deseado de oxígeno.
Nuevo enfoque:el catalizador de óxido produce el espín de electrones deseado
Este es un nuevo enfoque porque implica que los giros de los radicales adsorbidos en las superficies de los catalizadores, a partir de los cuales se forman los subproductos, se alinean en paralelo. Tal alineación paralela de los espines de los electrones se puede lograr utilizando un material quiral. En este caso, la transferencia de electrones a través de los electrodos como consecuencia del efecto CISS, oa través del cambio estructural en el óxido, puede ser de espín selectivo. En consecuencia, se suprime la formación de moléculas en el estado de singlete no deseado y se incrementa el rendimiento de hidrógeno.
Si bien los investigadores demostraron con éxito la catálisis de espín selectivo, todavía no se comprende por completo el origen del efecto CISS. Se ha demostrado la transmisión selectiva de espín de electrones a través de moléculas helicoidales y, por lo tanto, también quirales. However, more recent studies show that spin-selective transmission also occurs in inorganic, non-molecular chiral materials. Inorganic, spin-filtering surfaces are more stable, chemically, than chiral molecular layers and permit greater current densities in the context of spin-selective catalysis.
The current study in detail
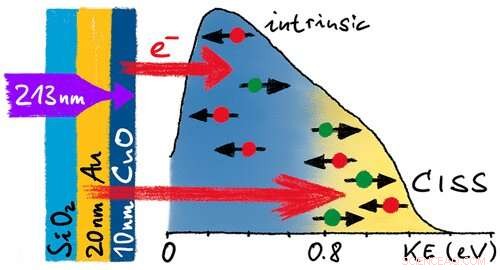
In the study now published, lead author Paul Möllers, a Ph.D. student at Münster University, examined chiral copper oxide films with a thickness of just a few nanometers which had previously been electrochemically deposited in a chiral form onto thin gold substrates by researchers from Pittsburgh. UV laser pulses were used to stimulate photoelectrons from the samples and their mean spin polarization was measured (in a spin polarimeter based on "Mott scattering"). Depending on whether the samples were hit from the oxide-covered front side or from the reverse side, in the process electrons with different energies were emitted from the gold substrate or from the oxide films themselves, in different proportions. By correlating the energy distribution with the spin polarization values measured, the Münster researchers showed that the electrons from both layers are polarized to different extents.
The electrons from the gold substrate are filtered, as regards their spin, by the CISS effect as they pass through the chiral layer. The electrons from the chiral copper oxide display an opposite spin polarization, and in the case of films with a thickness of more than 40 nanometers, there is a preponderance of these copper oxide electrons. Additional measurements carried out by the working group led by Prof. Heiko Wende at the Department of Physics at the University of Duisburg-Essen suggest that this reflects a magnetic arrangement in the chiral layers which is not observed in non-chiral oxide films with the same composition.
In order to follow up this hypothesis, the experimental set-up in Münster will be extended by having the possibility of measuring the spin polarization in electrons depending directly on their energy. Further measurements on chiral copper and cobalt oxide films will enable not only a clear differentiation to be made between both polarization mechanisms, but also chiral inorganic spin-selective catalyst materials to be designed specifically. Chirality and chiral-induced spin selectivity