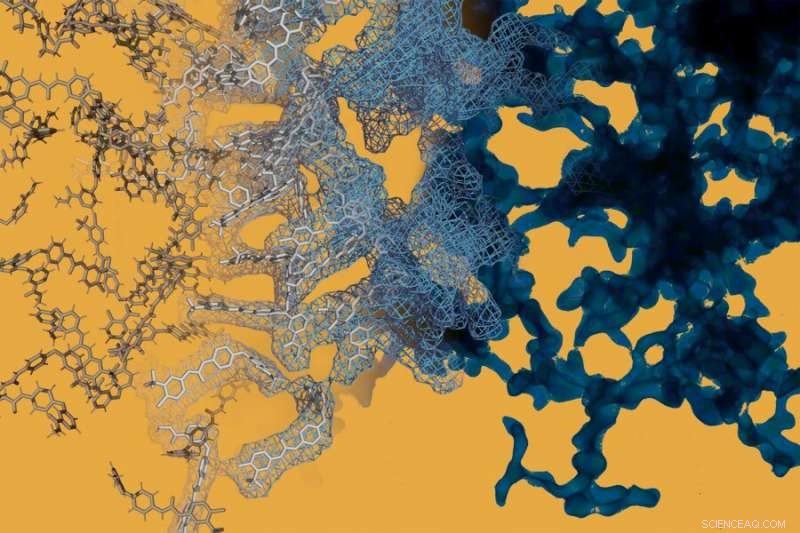
Una simulación de dinámica molecular (izquierda) se yuxtapone con una imagen de microscopía electrónica (derecha) del medicamento contra el cáncer sorafenib. Sorafenib, como muchos otros medicamentos de molécula pequeña, puede formar espontáneamente intrincadas estructuras a nanoescala que cambian el comportamiento de la droga. Crédito:Daniel Reker
Las terapias de moléculas pequeñas tratan una amplia variedad de enfermedades, pero su eficacia a menudo se ve disminuida debido a su farmacocinética, es decir, lo que hace el cuerpo con un fármaco. Después de la administración, el cuerpo dicta la cantidad de droga que se absorbe, en qué órganos entra la droga, y la rapidez con que el cuerpo metaboliza y excreta la droga nuevamente.
Nanopartículas, generalmente hecho de lípidos, polímeros, o ambos, puede mejorar la farmacocinética, pero pueden ser complejos de producir y, a menudo, contienen muy poca droga.
Se ha demostrado que algunas combinaciones de medicamentos contra el cáncer de molécula pequeña y dos colorantes de molécula pequeña se autoensamblan en nanopartículas con cargas útiles de medicamentos extremadamente altas. pero es difícil predecir qué socios de moléculas pequeñas formarán nanopartículas entre los millones de posibles emparejamientos.
Los investigadores del MIT han desarrollado una plataforma de detección que combina el aprendizaje automático con la experimentación de alto rendimiento para identificar nanopartículas autoensambladas rápidamente. En un estudio publicado en Nanotecnología de la naturaleza , los investigadores examinaron 2,1 millones de combinaciones de fármacos de molécula pequeña e ingredientes de fármacos "inactivos", identificar 100 nuevas nanopartículas con aplicaciones potenciales que incluyen el tratamiento del cáncer, asma, malaria, e infecciones víricas y micóticas.
"Hemos descrito anteriormente algunos de los efectos negativos y positivos que los ingredientes inactivos pueden tener sobre las drogas, y aquí, a través de una colaboración concertada entre nuestros laboratorios e instalaciones centrales, describir un enfoque centrado en los posibles efectos positivos que pueden tener en la nanoformulación, "dice Giovanni Traverso, Karl Van Tassel (1925), profesor de desarrollo profesional de ingeniería mecánica, y autor principal correspondiente del estudio.
Sus hallazgos apuntan a una estrategia que resuelve tanto la complejidad de producir nanopartículas como la dificultad de cargar grandes cantidades de medicamentos en ellas.
"Hay tantos medicamentos que no alcanzan todo su potencial debido a una focalización insuficiente, baja biodisponibilidad, o metabolismo rápido de fármacos, "dice Daniel Reker, autor principal del estudio y ex postdoctorado en el laboratorio de Robert Langer. "Al trabajar en la interfaz de la ciencia de datos, aprendizaje automático, y entrega de medicamentos, nuestra esperanza es expandir rápidamente nuestro conjunto de herramientas para asegurarnos de que un medicamento llegue al lugar que necesita y realmente pueda tratar y ayudar a un ser humano ".
Langer, el profesor del Instituto David H. Koch en el MIT y miembro del Instituto Koch para la Investigación Integrativa del Cáncer, también es un autor principal del artículo.
Una terapia contra el cáncer encuentra su pareja
Para desarrollar un algoritmo de aprendizaje automático capaz de identificar nanopartículas autoensambladas, Los investigadores primero necesitaban construir un conjunto de datos en el que se pudiera entrenar el algoritmo. Seleccionaron 16 fármacos de moléculas pequeñas autoagregantes con una variedad de estructuras químicas y aplicaciones terapéuticas y un conjunto diverso de 90 compuestos ampliamente disponibles. incluidos los ingredientes que ya se han añadido a los medicamentos para que sepan mejor, durar más, o hacerlos más estables. Debido a que tanto los medicamentos como los ingredientes inactivos ya están aprobados por la FDA, Es probable que las nanopartículas resultantes sean más seguras y pasen por el proceso de aprobación de la FDA más rápidamente.
Luego, el equipo probó cada combinación de fármaco de molécula pequeña e ingrediente inactivo, habilitado por el Centro de Biotecnología Swanson, un conjunto de instalaciones centrales que brindan servicios técnicos avanzados dentro del Instituto Koch. Después de mezclar emparejamientos y cargar 384 muestras a la vez en placas de nanopozos utilizando robótica en el núcleo de High Throughput Sciences, los investigadores caminaron por los platos, a menudo con muestras que se degradan rápidamente, al lado del núcleo de la instalación central de materiales de nanotecnología de Peterson (1957) para medir el tamaño de las partículas con dispersión de luz dinámica de alto rendimiento.
Ahora entrenado en 1, 440 puntos de datos (con 94 nanopartículas ya identificadas), la plataforma de aprendizaje automático podría activarse en una biblioteca de compuestos mucho más grande. Detección de 788 fármacos de molécula pequeña frente a más de 2, 600 ingredientes farmacológicos inactivos, la plataforma identificada 38, 464 nanopartículas de autoensamblaje potenciales de 2,1 millones de combinaciones posibles.
Los investigadores seleccionaron seis nanopartículas para su posterior validación, incluido uno compuesto de sorafenib, un tratamiento comúnmente utilizado para el hígado avanzado y otros cánceres, y glicirricina, un compuesto que se utiliza con frecuencia como aditivo alimentario y farmacológico y más comúnmente conocido como aroma de regaliz. Aunque el sorafenib es el tratamiento estándar para el cáncer de hígado avanzado, su eficacia es limitada.
En cultivos de células de cáncer de hígado humano, las nanopartículas de sorafenib-glicirricina funcionaron dos veces más que el sorafenib por sí solo porque una mayor cantidad del fármaco podría ingresar a las células. Trabajando con el modelado preclínico, Instalación de imágenes y pruebas en el Instituto Koch, Los investigadores trataron modelos de ratón de cáncer de hígado para comparar los efectos de las nanopartículas de sorafenib-glicirricina frente a cualquiera de los compuestos por sí mismos. Descubrieron que la nanopartícula redujo significativamente los niveles de un marcador asociado con la progresión del cáncer de hígado en comparación con los ratones que recibieron sorafenib solo. y vivieron más que los ratones que recibieron sorafenib o glicirricina sola. La nanopartícula de sorafenib-glicirricina también mostró una mejor orientación al hígado en comparación con la administración oral de sorafenib. el estándar actual en la clínica, o al inyectar sorafenib después de haber sido combinado con cremophor, un vehículo de fármaco de uso común que mejora la solubilidad en agua pero tiene efectos secundarios tóxicos.
Entrega de medicamentos personalizada
La nueva plataforma puede tener aplicaciones útiles más allá de optimizar la eficiencia de los fármacos activos:podría usarse para personalizar compuestos inactivos para satisfacer las necesidades de pacientes individuales. En un trabajo anterior, Los miembros del equipo encontraron que los ingredientes inactivos podrían provocar reacciones alérgicas adversas en algunos pacientes. Ahora, con la caja de herramientas ampliada de aprendizaje automático, se podrían generar más opciones para brindar alternativas a estos pacientes.
"Tenemos la oportunidad de pensar en hacer coincidir el sistema de administración con el paciente, "explica Reker, ahora es profesor asistente de ingeniería biomédica en la Universidad de Duke. "Podemos dar cuenta de cosas como la absorción de fármacos, genética, incluso alergias para reducir los efectos secundarios en el momento del parto. Cualquiera que sea la mutación o condición médica, el medicamento correcto es solo el medicamento correcto si realmente funciona para el paciente ".
Las herramientas para la seguridad existe una administración eficaz de fármacos, pero juntar todos los ingredientes puede ser un proceso lento. La combinación de aprendizaje automático, detección rápida, y la capacidad de predecir interacciones entre diferentes combinaciones de materiales acelerará el diseño de fármacos y las nanopartículas que se utilizan para administrarlos por todo el cuerpo.
En el trabajo en curso, El equipo busca no solo mejorar la administración eficaz de medicamentos, sino también oportunidades para crear medicamentos para personas para quienes las formulaciones estándar no son una buena opción. el uso de macrodatos para resolver problemas en poblaciones pequeñas al observar la historia genética, alergias y reacciones a los alimentos.
Esta historia se vuelve a publicar por cortesía de MIT News (web.mit.edu/newsoffice/), un sitio popular que cubre noticias sobre la investigación del MIT, innovación y docencia.