
Propiedades nanomecánicas de las fibrillas ILQINS. a) altura AFM, b) altura 3D AFM, c) amplitud AFM, yd) módulo AFM DMT de fibrillas ILQINS. e) Módulo DMT de fibrillas ILQINS de la parte (d). f) El histograma de módulos DMT de fibrillas ILQINS. Crédito: Ciencia avanzada , doi:10.1002 / advs.202002182
Los amiloides se refieren a depósitos fibrosos extracelulares y proteicos anormales que se encuentran en órganos y tejidos que forman construcciones insolubles que son resistentes a la degradación. Su formación puede acompañar a la enfermedad, donde cada enfermedad se caracteriza por una proteína o péptido agregado específico. Las propiedades nanomecánicas de las fibrillas amiloides y los nanocristales dependen de su estructura secundaria y cuaternaria y de su geometría intermolecular. Los científicos han utilizado métodos avanzados de obtención de imágenes, incluida la microscopía de fuerza atómica (AFM) para desentrañar la heterogeneidad morfológica y mecánica de los amiloides, aunque es difícil obtener un conocimiento completo basado en métodos espectroscópicos convencionales.
En un informe reciente ahora publicado en Ciencia avanzada , Jozef Adamcik y un equipo internacional de investigadores de la ETH Zurich, la Universidad de Cambridge, la Universidad de Luxemburgo y la Universidad de Shanghai, demostraron métodos combinados de nanoespectroscopía de molécula única. Combinaron las técnicas con el modelado atómico para comprender la transición estructural de las fibrillas amiloides a los microcristales amiloides basados en hexapéptidos a nanoescala. Atribuyeron el origen de la rigidez a un mayor contenido de estructuras de láminas β intermoleculares. La mayor rigidez en los módulos de Young se correlacionó con una mayor densidad de enlaces de hidrógeno intermoleculares y estructuras paralelas de láminas β para estabilizar energéticamente los cristales.
Amiloides en la ciencia de los materiales
Los amiloides son estructuras altamente ordenadas que surgen de proteínas o péptidos y están asociadas con una variedad de enfermedades que incluyen numerosos trastornos neurodegenerativos como el Alzheimer, Parkinson Enfermedades de Creutzfeldt ‐ Jakob, y encefalopatías espongiformes bovinas. Comprender sus propiedades biofísicas puede proporcionar mucha información nueva para inhibir su formación. En ciencia de materiales, sin embargo, la capacidad de un gran número de péptidos y proteínas de autoensamblarse en estructuras amiloides abre un método para usarlos para desarrollar nuevos nanomateriales para aplicaciones biomédicas y nanotecnológicas. Como resultado, Los científicos de materiales están ansiosos por obtener un conocimiento detallado de la estructura y morfología de los amiloides en un contexto más amplio para aplicaciones en la medicina a la nanotecnología. En este trabajo, Adamcik y col. examinó el polimorfismo de los sistemas de modelos de hexapéptidos y utilizó las capacidades de una sola molécula de microscopía de fuerza atómica de mapeo nanomecánico cuantitativo de fuerza máxima (PF-QNM-AFM) para el análisis. El método combinó AFM (microscopía de fuerza atómica) y técnicas de infrarrojos con modelado atómico para estudiar y correlacionar la nanomecánica, propiedades químicas y estructurales de la fibrilla y sus formas cristalinas a escala de un solo agregado.

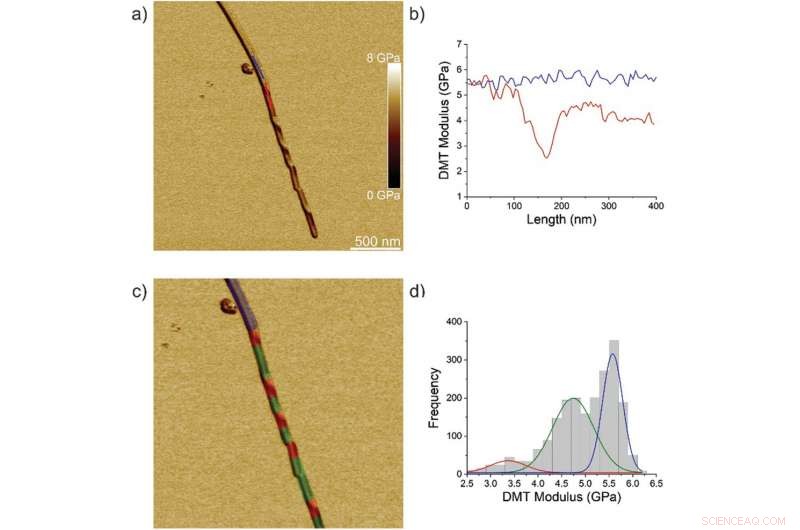
Propiedades nanomecánicas de las fibrillas IFQINS (F), cristales intermedios (IC), y cristales (C). a) altura AFM, b) altura 3D AFM, c) amplitud AFM, y d) módulo AFM DMT de fibrillas IFQINS. e) Módulo DMT de fibrillas IFQINS de la parte (d). f) El histograma de módulos DMT de fibrillas IFQINS. El color rojo corresponde a los módulos DMT de las fibrillas, el verde muestra cristales intermedios y el azul corresponde a los módulos DMT de los cristales. Crédito: Ciencia avanzada , doi:10.1002 / advs.202002182
Microscopía de fuerza atómica de mapeo nanomecánico cuantitativo de fuerza máxima (PF-QNM-AFM)
El equipo analizó primero los hexapéptidos de ILQINS (un segmento de formación de amiloide) individualmente para comprender la diferencia en las propiedades nanomecánicas y estructurales. Extrajeron los módulos de Young de alrededor de 30 fibrillas diferentes con valores (2-3 GPa) típicos de las fibrillas amiloides. Luego observaron otro hexapéptido IFQINS, otro segmento formador de amiloide, para mostrar la coexistencia de fibrillas con una estructura de cintas helicoidales derechas, Cintas retorcidas para diestros y zurdos, cristales intermedios y cristales. En este caso, los módulos de Young eran diferentes, y permitió a los investigadores distinguir cada morfología estructural. Por ejemplo, las fibrillas mostradas en rojo tenían módulos de Young en el rango de 2-3 GPa, muy parecido a las fibrillas autoensambladas a partir de ILQINS. Para los cristales representados en azul, los módulos estaban en el rango de 5-6 GPa, mientras que los cristales intermedios vistos en verde se extendieron a través de 2-5 GPa. Adicionalmente, las estructuras amiloides TFQINS autoensambladas en microcristales con una pequeña cantidad de cintas retorcidas, con tendencias similares a los hexapéptidos IFQINS. El equipo también obtuvo un análisis detallado de los módulos de Young de una transición de fibrillas a cristales de TFQINS.
Propiedades nanomecánicas de los cristales TFQINS. a) altura AFM, b) altura 3D AFM, c) amplitud AFM, y d) módulo AFM DMT de cristales TFQINS. e) Módulo DMT de cristales de TFQINS de la parte (d). f) El histograma de los módulos DMT de los cristales de TFQINS de la parte (e). Crédito: Ciencia avanzada , doi:10.1002 / advs.202002182
Nanoespectroscopia infrarroja (AFM-IR)
Adamcik y col. luego aplicó espectroscopía infrarroja (IR) para comprender mejor la correlación entre las propiedades nanomecánicas y la heterogeneidad de la estructura química secundaria de las fibrillas individuales y los cristales. Seleccionaron los péptidos IFQINS para los experimentos con la herramienta AFM-IR debido a su heterogeneidad. Los científicos observaron mapas de morfología utilizando la técnica para mostrar la coexistencia de fibrillas retorcidas y cristales a nanoescala. El sistema AFM-IR permitió la resolución espectroscópica de las bandas de amida que se conocen típicamente como huellas dactilares de proteínas o péptidos. Los científicos investigaron los cambios estructurales sutiles durante la transición del estado fibrilar al cristal intermedio al cristal. para indicar un aumento neto del contenido de la hoja β paralela intermolecular y un ligero aumento de la conformación de la hoja β antiparalela. El equipo atribuyó el resultado al aumento del módulo de Young desde la fibrilla hasta los estados de cristal, donde el método de espectroscopía IR y la indentación AFM proporcionaron una sinopsis de la organización a escala atómica.
Simulaciones atómicas
A continuación, los investigadores realizaron simulaciones atomísticas del proceso de indentación para investigar más a fondo los cambios en las propiedades del material amiloide después de adquirir el orden cristalino. Utilizaron péptidos ILQINS para estas simulaciones para comprender versiones de modelos amiloides gruesos y delgados. La estructura delgada tenía una columna vertebral menos compacta en comparación con la estructura gruesa. Los módulos de cristales de Young excedieron los de los amiloides retorcidos en 3.6 GPa para mostrar que el orden de los cristales es mayor que las fibrillas, al igual que con la sangría experimental. Tomados en conjunto, Los resultados mostraron que la transición de fibrillas a cristales en el amiloide se asociaba con un aumento de la lámina β intermolecular y el enlace de hidrógeno que resultó en el cambio de la banda de amida I a frecuencias vibratorias más bajas. Este cambio permitió que la estructura cristalina se estabilizara basándose en la entropía vibratoria y el orden de largo alcance de los enlaces H. El trabajo proporcionó un proceso claro de transiciones de fibrillas a cristales para formar cristales de tipo amiloide excepcionalmente estables.
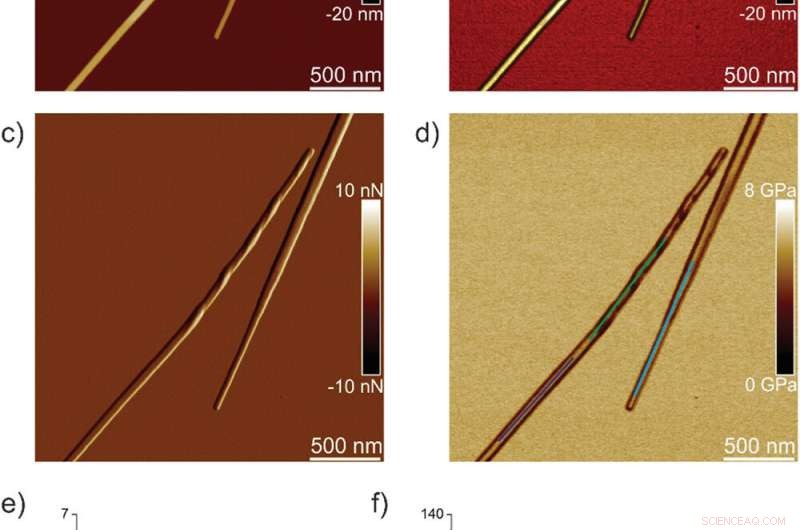
Propiedades nanomecánicas de la transición fibrilla / cristal de TFQINS. a) Módulo AFM DMT del cristal TFQINS. b) Módulo DMT del cristal TFQINS del inciso a). c) Módulo AFM DMT del cristal TFQINS teñido de rojo, verde o azul por la región asignada. d) El histograma de módulos DMT de cristales TFQINS. Los colores rojo y verde indican secciones torcidas o planas de la región de transición de fibrillas / cristales, respectivamente; el azul corresponde a la región cristalina. Crédito: Ciencia avanzada , doi:10.1002 / advs.202002182
panorama
De este modo, Jozef Adamcik y sus colegas combinaron imágenes de microscopía de fuerza atómica de una sola molécula, nanoindentación y espectroscopía química a nanoescala con modelado atómico para comprender las propiedades nanomecánicas y vibracionales de los polimorfos amiloides. Observaron la transición de fibrillas a microcristales e investigaron una serie de fragmentos de hexapéptidos (incluidos ILQINS, IFQINS, y TFQINS). Las fibrillas amiloides y los microcristales mostraron diferentes módulos de Young, donde los cristales de amiloide tenían valores mayores debido a la mayor densidad y orden de las láminas β intermoleculares en las arquitecturas de microcristales. El trabajo proporcionó un mapa sin precedentes de lo atomístico, mesoscópico y propiedades vibratorias del agregado amiloide para elaborar los orígenes moleculares de los cristales amiloides termodinámicamente estables para aplicaciones en la ciencia de los materiales hasta la nanomedicina.
© 2020 Science X Network