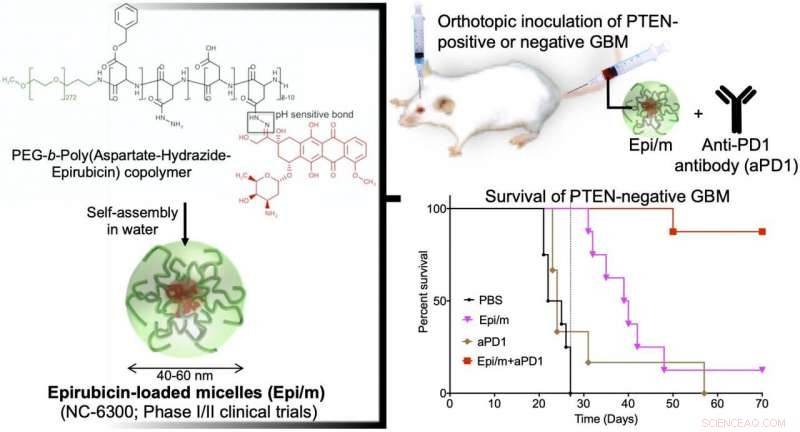
Izquierda:la epirrubisina hidrófoba se conjuga a un extremo de la cadena de polietilenglicol hidrófilo (PEG) con aspartato-hidrazida como enlazador. En agua, esta molécula se autoensambla para formar nano-micelas (Epi / m). Arriba a la derecha:PTEN (+) o PTEN (-) GBM se trasplantó al cerebro de ratones, y se administraron Epi / my anticuerpo anti-PD1 (aPD1) a través de la vena de la cola para evaluar el período de supervivencia. Abajo a la derecha:Comparación del período de supervivencia en caso de PTEN (-) GBM. Se administró PBS (solución tampón de fosfato) al grupo de control. Como resultado, ninguno del grupo de control (negro) pudo sobrevivir más de 30 días (8/8). El grupo de Epi / m solo (rosa) murió gradualmente después de 30 días, la mitad (4/8) en 40 días, y 7/8 por 50 días. aPD1 solo (marrón) mató a 6/7 en 30 días. A diferencia de, usando Epi / m + aPD1 (rojo), 1/8 murió 50 días después, pero 7/8 estaban vivos incluso después de 3 meses. Crédito:Centro de Innovación de NanoMedicina 2020
Una estrategia basada en nanomedicina para la quimioinmunoterapia (CIT) del glioblastoma (GBM), que tiene el peor pronóstico entre los tumores cerebrales, fue desarrollado con éxito. Los experimentos in vivo demostraron que el uso combinado de nanomicelas encapsulantes de epirrubicina (Epi / m) con inhibidores de puntos de control inmunitarios (ICI) erradicó el GBM PTEN negativo, que es altamente resistente a ICI solo. Debido a los efectos sinérgicos de la combinación Epi / m más ICI, el número de células T infiltrantes de tumores (TIL) y otras células inmunitarias antitumorales aumentó significativamente para destruir las células cancerosas de manera eficaz.
Por otra parte, células inmunosupresoras intratumorales derivadas de la médula ósea (MDSC), que interfieren con la respuesta inmune, se redujeron significativamente. El CIT también proporcionó fuertes efectos de memoria inmunológica contra los tumores, que efectivamente rechazó las células GBM negativas para PTEN recién implantadas en el cerebro. Si bien la epirrubicina libre puede dañar los órganos, incluyendo órganos hematopoyéticos especialmente, nuestra estrategia de nanomedicina redujo significativamente estos efectos secundarios, mejorando la respuesta inmune. Epi / m ya ha avanzado en ensayos clínicos para otros tipos de cáncer, y se podría esperar que esta estrategia de CIT se traduzca en evaluación clínica en el futuro. Estos resultados han sido publicados en ACS Nano el 6 de agosto por la American Chemical Society.
El Centro de Innovación de Nanomedicina (Director:Prof. Kazunori Kataoka, Ubicación:Kawasaki-City, Abreviatura:iCONM) anunció que se demostró una nueva opción terapéutica para el glioblastoma (GBM) en ratones, en un estudio de colaboración con el Departamento de Bioingeniería, Escuela de Graduados en Ingeniería, La Universidad de Tokio. El GBM es un tumor cerebral de progresión extremadamente rápida y mal pronóstico (tasa de supervivencia a 5 años:10,1%). Aunque se están evaluando varios compuestos en estudios clínicos, no existe una opción terapéutica para mejorar significativamente el período de supervivencia. En particular, pacientes con anomalías en el gen PTEN, uno de los genes supresores del cáncer, son muy resistentes a las terapias disponibles en la actualidad y tienen grandes necesidades médicas.
En general, Los inhibidores de puntos de control inmunitarios (ICI) se consideran ineficaces contra GBM, ya que GBM es inmunosupresor con infiltración de células T baja. En el método presentado en este documento, La tecnología de administración de nanofármacos de iCONM permite la acumulación tumoral selectiva de epirrubicina, que causa la muerte celular inmunogénica (ICD), a los tejidos tumorales, de este modo, causando ICD localmente para sinergizar con ICI. Como resultado, esta quimioinmunoterapia (CIT) basada en nanomedicina fue eficaz en ratones trasplantados con GBM en el cerebro (en lo sucesivo, modelo GBM de ratón), y logró prolongar significativamente la supervivencia de los ratones. La combinación de los ratones tratados con nano-micelas cargados con epirrubicina mostró una alta infiltración de células T citotóxicas (TIL) y una disminución de las células inmunosupresoras derivadas de la médula ósea (MDSC). Finalmente, se observó la supresión de la función de punto de control inmunológico.
Las mutaciones en el gen PTEN ocurren con frecuencia en GBM, dando lugar a vías inmunosupresoras que promueven la resistencia a las ICI. Por lo tanto, mientras que las ICI erradicaron el 40% de los tumores en un modelo de GBM de ratón en el que el gen PTEN es normal, en un modelo en el que se eliminó el gen PTEN, Las ICI no pudieron prolongar la supervivencia de los ratones. A nivel celular, se encontró que las células deficientes en PTEN (CT2A-luc) expresaban aproximadamente 5 veces más PDL1 que las células normales, lo que probablemente esté relacionado con la resistencia terapéutica con ICI. Como la epirrubicina ha demostrado la capacidad de suprimir la expresión de PDL1 en tumores, como el cáncer de mama, sería posible disminuir los niveles de PDL1 de GBM si se pudiera administrar una cantidad suficiente de epirrubicina a las lesiones de GBM. Por lo tanto, Se utilizaron CIT que utilizan nanomicelles que contienen epirrubicina (Epi / m) en combinación de ICI para mejorar la eficacia antitumoral contra GBM.
En un modelo GBM con expresión PTEN normal (GL261-luc), Epi / m (5 mg / kg en base a Epi) más anticuerpos anti-PD1 (5 mg / kg) dieron como resultado la supervivencia de todos los ratones durante más de 70 días, con una notable extensión del tiempo de supervivencia. En este modelo, Los ratones tratados con PBS murieron en 30 días. los ratones tratados con anticuerpos anti-PD1 solos (5 mg / kg) permitieron que el 40% de los ratones sobrevivieran durante al menos 70 días, y Epi / m (5 mg / kg de base Epi) resultó en el 80% de la supervivencia de los ratones durante más de 70 días. A diferencia de, en el modelo deficiente de PTEN (CT2A-luc), Epi / m (5 mg / kg en base a Epi) más anticuerpos anti-PD1 (5 mg / kg) dieron como resultado solo el 30% de la supervivencia de los ratones durante más de 70 días, y no se pudo confirmar ningún efecto de supervivencia claro para los otros grupos de control. Cuando se aumentó la dosis a 15 mg / kg de Epi / m (en base a Epi) y se combinó con anticuerpos anti-PD1 (5 mg / kg), El 90% de los ratones pudieron sobrevivir durante más de 70 días. prolongando notablemente la supervivencia de los ratones.