Dibujo esquemático de la fabricación de las membranas diseñadas mediante electrohilado de PCL y PDA NP. Crédito:NPG Asia Materials, doi:10.1038 / s41427-019-0139-5
En un nuevo estudio ahora publicado en Materiales de NPG Asia , Los bioingenieros informan del desarrollo de una nueva membrana fibrosa con células madre para reparar defectos óseos en los cráneos de ratones. Para esto, incorporaron proteína polidopamina inspirada en el mejillón como un compuesto prometedor para unir sustancias biológicas a las superficies de las membranas, al igual que las proteínas adhesivas en los mejillones. En el trabajo, Yi Deng y un equipo de investigación en los departamentos interdisciplinarios de ingeniería química, Ingeniería Mecánica, tecnología de materiales, centro de materiales futuros y medicina regenerativa en China y Australia, recubrió las membranas biocompatibles con nanopartículas de polidopamina para formar muchos sitios topológicos para la fijación del calcio y la reparación de defectos óseos.
El equipo incubó las membranas recubiertas y no recubiertas con células madre aisladas de la médula ósea e implantó las membranas para regenerar los defectos óseos del cráneo en ratones vivos. Después de un estudio traslacional de 2 meses, revelaron la capacidad de las membranas pegajosas para dirigir las células madre a producir cantidades significativamente mayores de hueso, en comparación con las membranas sin recubrimiento. Los defectos y lesiones óseas pueden ocurrir comúnmente a nivel microscópico como defectos congénitos, debido a accidentes o como enfermedad degenerativa relacionada con la edad. La mayoría de los defectos óseos no pueden repararse espontáneamente mediante mecanismos de autocuración, lo que genera la necesidad urgente de desarrollar biomateriales robustos que faciliten la reparación ósea en la investigación ósea y la ingeniería de tejidos óseos.
Los bioingenieros pueden manipular la diferenciación de células madre para formar osteoblastos maduros a través de la regeneración tisular guiada (GTR) en las membranas de la superficie para optimizar, Regeneración ósea a gran escala. En ciencia de materiales y materiales funcionales avanzados, Las membranas electrohiladas han recibido una atención masiva para tales estrategias guiadas de ingeniería de tejidos debido a varias ventajas biocompatibles, incluso:
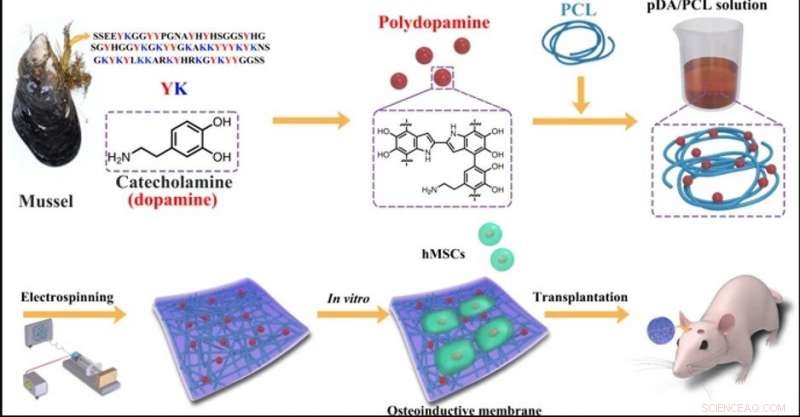
ARRIBA:Micromorfologías de NP de PDA y membranas fibrosas electrohiladas de PDA / PCL. una imagen TEM de PDA NP; b Imágenes SEM del (b1) prístino PCL, (b2) 1% PDA / PCL, (b3) 2% PDA / PCL, (b4) 5% PDA / PCL, y (b5) membranas fibrosas de PDA / PCL al 10%. Las flechas rojas en b apuntan a los filamentos. INFERIOR:Componentes químicos de las membranas fibrosas PDA / PCL. (a) Espectros Raman y (b) ángulos de contacto con imágenes de gotas de agua correspondientes de membranas fibrosas PDA / PCL. Crédito:NPG Asia Materials, doi:10.1038 / s41427-019-0139-5
Los científicos de materiales clasifican los materiales sintéticos GTR en dos categorías principales:(1) materiales bioabsorbibles y (2) materiales no absorbibles; donde los materiales no absorbibles deben eliminarse después de la implantación mediante una segunda cirugía, causando un aumento en los gastos de atención médica, al tiempo que compromete el tejido recién generado. A diferencia de, membranas biodegradables como el alcohol polivinílico (PVA), Se prefieren poli (lactida-co-glicólido) (PLGA) o PCL para implantes clínicos, aunque las complicaciones biológicas han impedido seriamente su adopción clínica.
En el presente trabajo, por lo tanto, Deng y col. utilizó la proteína adhesiva bioinspirada secretada por los mejillones como un revestimiento superficial fácil e independiente del material, estrategia de ingeniería basada en la química catecol. La polidopamina (PDA) puede facilitar la diferenciación osteoblástica de las células madre en una variedad de sustratos como un recubrimiento de biomateriales a nanoescala, para apoyar la unión de las células madre mesenquimales e inducir la reprogramación de las células somáticas humanas. Sin embargo, Las nanocapas de PDA pueden deslaminarse fácilmente de las superficies para inducir la apoptosis celular local o reacciones inflamatorias como efectos adversos. Deng y col. implementó pasos experimentales específicos para superar las limitaciones existentes y desarrollar una nueva membrana biocompatible y biodegradable en el laboratorio. El biomaterial o la membrana fibrosa de nuevo diseño proporcionarán un nicho favorable para dirigir el destino de las células madre locales para formar osteoblastos para la regeneración ósea.
Paso uno:Ingeniería PCL incluida en PDA (PDA / PCL) con electrohilado
Los científicos utilizaron la química del catecol para la fabricación y síntesis de membranas fibrosas de PDA / PCL. Dispersaron uniformemente las nanopartículas de PDA (NP) en PCL mediante sonicación continua y agitación con vórtice para formar las membranas fibrosas mediante electrohilado. Deng y col. utilizó un microscopio electrónico de barrido (SEM) y observó las propiedades de la superficie del azar, red fibrosa del tamaño de una micra. Relativamente, las membranas electrohiladas de PCL puro permanecieron lisas, mientras que la integración de PDA NP hizo rugosas las superficies de las fibras. Los científicos confirmaron la nueva química de la superficie utilizando espectros Raman y análisis de espectroscopía de fotoelectrones de rayos X (XPS). Los biomateriales eran hidrófilos, lo que permitía la adsorción de proteínas y la unión celular. Los investigadores realizaron mediciones del ángulo de contacto para verificar la humectabilidad de la superficie y la hidrofilicidad mejorada después de la modificación del PDA en comparación con el puro, membranas PCL sin modificar.
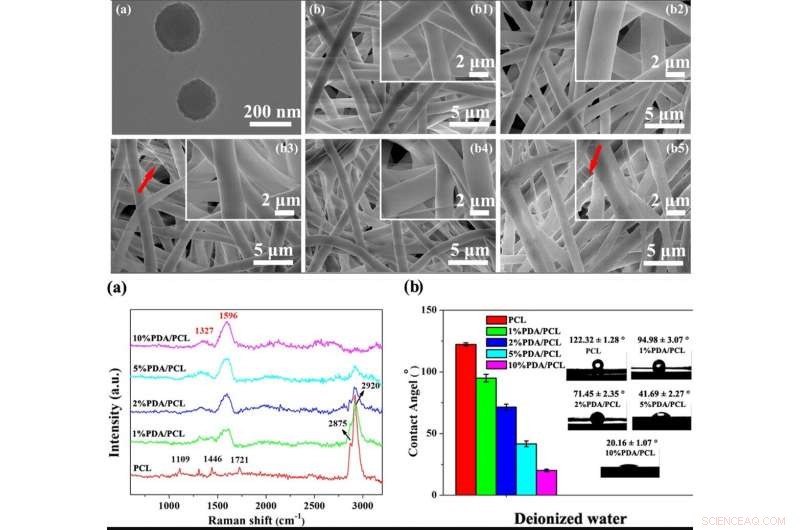
ARRIBA:Formación de nódulos en forma de hueso. (a) Fotografías SEM de membranas fibrosas PDA / PCL adquiridas después de remojarlas en SBF durante 7 y 14 días. (b) Datos de EDS y relaciones Ca / P de los sedimentos de partículas en la superficie de las membranas fibrosas de PDA / PCL a los 14 días. INFERIOR:Adhesión y proliferación celular. (a) Observación SEM yb CLSM de hMSC adheridas en las membranas fibrosas diseñadas con diferentes concentraciones de NP de PDA a las 6 y 12 h. Las flechas rojas en un punto a los pseudópodos. Las inserciones en la parte superior derecha de (b) muestran las imágenes ampliadas de una sola celda. (c) Unión celular y (d) curvas de proliferación de hMSC en las superficies de muestra obtenidas mediante CCK-8. * Representa p <0.05 entre grupos, ** representa p <0.01 entre grupos; y # representa p <0,05 en comparación con otros grupos. Crédito:NPG Asia Materials, doi:10.1038 / s41427-019-0139-5
Paso dos:estudios de caracterización de superficies
Dado que las membranas bioactivas pueden integrarse con el tejido óseo circundante (tejido óseo), Deng y col. evaluó la formación de capas de apatita ósea en la superficie de biomateriales sumergidos en una solución de fluido corporal simulado (SBF). Después de 7 días de inmersión, los científicos observaron agregados nodulares agrupados en las membranas PDA / PCL, que aumentó drásticamente el día 14. Comparativamente, la muestra de control de PCL prístino sin modificar retuvo depósitos de Ca-P a los siete días, con islas de apatita el día 14. A medida que aumentaba el contenido de PDA, por lo tanto, aumentó la cantidad de apatita depositada en la superficie. Deng y col. utilizó los datos de caracterización del material para validar la bioactividad in vitro mejorada de las membranas de PDA / PCL en comparación con el control de PCL puro.
Paso tres:estudios de biofuncionalización
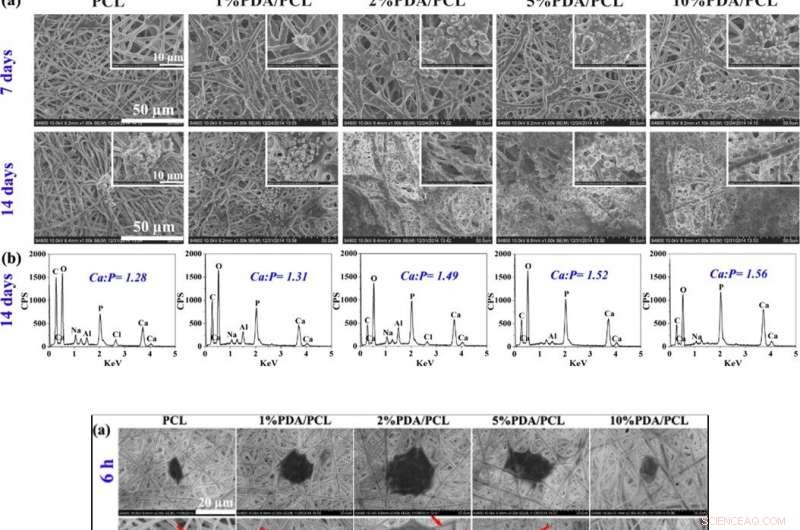
Los científicos evaluaron la citocompatibilidad (biocompatibilidad celular) de las membranas de PDA / PCL diseñadas en relación con la adhesión celular. extensión, y proliferación de células madre mesenquimales humanas (hMSC). Las hMSC existen en gran medida en la médula ósea para ayudar a la reparación del tejido durante una lesión. Después de 6 horas de cultivo celular, las hMSC con formas celulares redondas no se adhirieron bien en PCL puro pero expresaron filopodios para la unión de la superficie de la membrana en tres variantes de membranas PDA / PCL. Utilizando experimentos de recuento celular y ensayos de viabilidad celular CCK-8, Deng y col. demostró que el contenido de PDA NP afectó significativamente al número de células viables adheridas a la superficie, y observaron propiedades superficiales óptimas con el grupo de PDA / PCL al 2 por ciento en el trabajo.
El equipo de investigación determinó la fórmula óptima para diseñar membranas de PDA / PCL para la regeneración guiada del tejido óseo mediante la determinación de la actividad de la fosfatasa alcalina (ALP) y la producción de matriz de calcio de las hMSC con tinción con Alizarin Red S (ARS). El crecimiento celular y la diferenciación osteogénica eran bajos cuando las cantidades de NP de PDA eran altas o bajas, porque las bajas concentraciones no desencadenaron el crecimiento celular, mientras que las altas concentraciones resultaron tóxicas en el estudio.
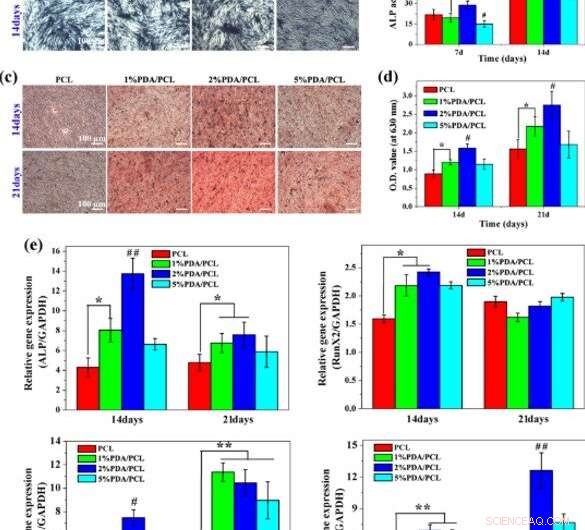
Diferenciación osteogénica:a, b Coloración y cuantificación de la actividad ALP, C, d Tinción con ARS y cuantificación de la producción de calcio, y e Análisis de RT-PCR para genes osteoespecíficos en diferentes membranas fibrosas PDA / PCL. * representa p <0.05 entre grupos, ** representa p <0.01 entre grupos. # representa p <0.05 en comparación con otros grupos, y ## representa p <0,05 en comparación con otros grupos. Crédito:NPG Asia Materials, doi:10.1038 / s41427-019-0139-5
Dado que las investigaciones a nivel molecular son una herramienta poderosa en biomateriales para bioingeniería, Deng y col. investigó la interacción entre las hMSC y las membranas diseñadas utilizando herramientas moleculares. Para esto, controlaron la expresión de los genes ALP relacionados con la osteogénesis, Runx2, Col1a1 y OPN en hMSC cultivadas en las membranas. A los 7 días observaron niveles sustanciales de expresión del gen ALP en la muestra al 2 por ciento de PDA / PCL.
Para el día 14, el nivel del gen Runx2 expresado en 1 y 2 por ciento de los grupos de PDA / PCL superó significativamente al grupo de PCL puro. Sin embargo, a los 21 días, los científicos no observaron una diferencia perceptible entre los cuatro grupos. Verificaron las observaciones utilizando tinción de inmunofluorescencia y eligieron las membranas de PDA / PCL al 2 por ciento para una inducción óptima de hMSC para diferenciarlos en osteoblastos maduros.
Paso cuatro:estudio traslacional
Guiado por los datos de experimentos in vitro, Deng y col. investigó la biofuncionalidad in vivo de la membrana microfibrosa utilizando un modelo animal. Para esto, crearon defectos óseos de tamaño crítico en cráneos de ratones y colocaron membranas fibrosas para cubrir los defectos, seguido de pruebas de formación ósea mediante micro tomografía computarizada (micro-CT), análisis histológicos y marcaje fluorescente; de cuatro a ocho semanas después de la implantación.
Cuando examinaron las imágenes tridimensionales de los cráneos micro-CT, la membrana de PDA / PCL al 2 por ciento ofrecía las áreas más grandes de formación de hueso nuevo, con considerable expansión al centro del defecto óseo. Los científicos obtuvieron un mayor contenido de matriz calcificada y remodelación ósea en el 2 por ciento de las membranas de PDA / PCL para una integración osteoconductora fenomenal.
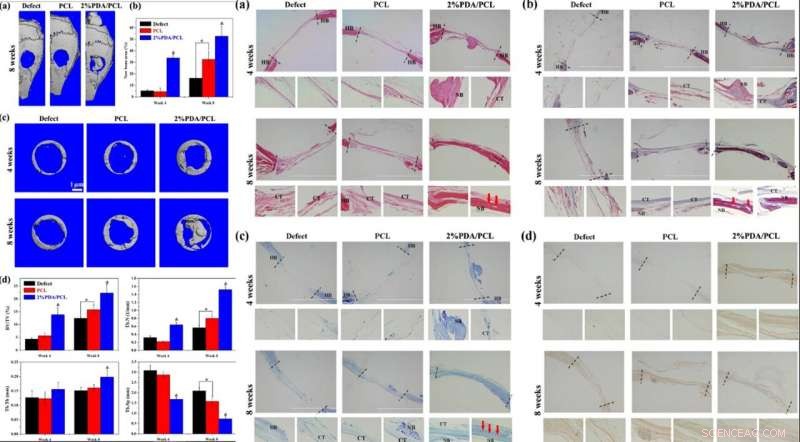
IZQUIERDA:Evaluación in vivo de membranas fibrosas PDA / PCL. (a) Imágenes de micro-TC 3D reconstruidas de cráneos completos después de la cirugía a las 8 semanas. (b) Cuantificación de áreas de hueso nuevo a las 4 y 8 semanas. (c) Imágenes de micro-TC de los defectos e histomorfometría ósea de implantes de membrana analizados a partir de los datos de micro-TC después de 4 y 8 semanas. * representa p <0.05 entre grupos, y &representa p <0,05 en comparación con otros grupos. DERECHA:Análisis histológico e inmunohistológico Análisis histológico e inmunohistológico de las secciones solo para defectos de calota y defectos implantados con PCL y membranas fibrosas de PDA / PCL al 2% a las 4 y 8 semanas posteriores a la implantación:(a) Tinción H&E, (b) Tinción de Masson, (c) tinción con azul de toluidina, (d) y tinción inmunohistológica de OCN. Hueso huésped HB; TC de tejido conectivo; NB hueso recién formado. Las flechas rojas en a – c apuntan al vaso sanguíneo. Crédito:NPG Asia Materials, doi:10.1038 / s41427-019-0139-5
La tinción con hematoxilina y eosina (H&E) reveló tejido fibroso en las cavidades del grupo PCL, con reestructuración ósea comparativamente visible en el grupo del 2 por ciento de PDA / PCL. Los científicos también observaron hueso con abundante vascularización después de 8 semanas después de la operación en los grupos de 2 por ciento de PDA / PCL. Llevaron a cabo una tinción adicional con Masson, tinción con azul de toluidina e inmunohistoquímica (IHC) para identificar en profundidad la formación de nuevo hueso y colágeno. Los datos histológicos combinados revelaron que el empleo de NP de PDA en membranas fibrosas diseñadas estimula significativamente la regeneración ósea, apoyando la hipótesis de que la osteodiferenciación in vitro también fue eficaz in vivo.
De este modo, Yi Deng y sus colaboradores crearon NP PDA co-hiladas con bioingeniería con un polímero sintético bioinerte para construir bioinspirados, membranas fibrosas PDA / PCL flexibles y osteopromotoras para aplicaciones de ingeniería de tejidos óseos en medicina regenerativa. La cantidad de NP de PDA incluidas en el compuesto mejoró significativamente la composición química, tamaño de la fibra y propiedades mecánicas de las membranas desarrolladas. Tanto los experimentos in vitro como los datos in vivo validaron la capacidad para la formación de hueso nuevo con construcciones de PDA / PCL al 2 por ciento en comparación con PCL puro. Las membranas de PCL / PDA diseñadas son osteoconductoras y fáciles de trasplantar con un gran potencial para aplicaciones de GTR.
© 2019 Science X Network