
Los investigadores ensamblaron tres nanoestructuras de ADN distintas, incluyendo una estructura en forma de C y dos en forma de barril, y mostró mediante microscopía electrónica de transmisión que estaban protegidos por su estrategia combinada de recubrimiento y reticulación. Crédito:Instituto Wyss de la Universidad de Harvard
Vencer al cáncer y una gran cantidad de otras enfermedades no solo depende de conseguir los medicamentos correctos, sino también de llevarlos a los lugares correctos del cuerpo. manteniendo al mínimo el daño a los tejidos sanos. Las nanoestructuras de ADN, como el origami de ADN autoensamblado que se pliega en formas definidas, son vehículos prometedores para la entrega de medicamentos y diagnósticos. y diferentes estrategias de vacunación. Esto se debe a que se pueden funcionalizar de manera flexible con fármacos de moléculas pequeñas y proteínas, y antígenos inmunogénicos, así como características que facilitan su entrega a células y tejidos diana específicos. Además, son biocompatibles y biodegradables.
El gran potencial de las nanoestructuras de ADN para diversas aplicaciones biomédicas, sin embargo, todavía se ve obstaculizada por su estabilidad limitada en los tejidos y la sangre del cuerpo. William Shih, Doctor. y su equipo ahora ha ideado un sencillo eficaz, y un enfoque de reticulación química escalable que puede proporcionar a las nanoestructuras de ADN la estabilidad que necesitan como vehículos de administración de fármacos y diagnósticos. Su estudio se publica en el Revista de la Sociedad Química Estadounidense ( JACS ).
"Para ayudar a cumplir la extraordinaria promesa de las nanoestructuras de ADN, Desarrollamos un enfoque químico de amplia aplicación para aumentar su resistencia a la degradación. "dijo William Shih, miembro del cuerpo docente principal del Wyss Institute que dirige el proyecto de la Iniciativa de Robótica Molecular del Instituto. "Al modificar las nanoestructuras de ADN en dos sencillos pasos, podemos mejorar drásticamente su supervivencia, que elimina un cuello de botella central en la traducción de esos nanodispositivos en soluciones para una variedad de problemas médicos ".
El origami de ADN generalmente se ensambla a partir de una larga hebra de ADN que se pliega en una forma tridimensional definida a una escala de nanómetros con la ayuda de múltiples hebras cortas que conectan diferentes partes de la estructura en el espacio. La columna vertebral del ADN está fuertemente cargada negativamente, lo que significa que acercar diferentes partes de los hilos plegables entre sí puede ser problemático porque se repelen naturalmente entre sí, similar a las superficies negativas de dos imanes. Para superar estas fuerzas repulsivas, Los investigadores comúnmente agregan un exceso de iones cargados positivamente como los iones de magnesio (Mg 2 + ) a sus reacciones de plegamiento que cubren las cargas negativas del ADN.
A menudo, sin embargo, el Mg agregado 2 + Los iones no se mantienen lo suficiente en las estructuras de origami de ADN 3-D. Especialmente cuando se introduce en el cuerpo, donde el Mg normal 2 + las concentraciones son mucho más bajas, Mg 2 + Los iones se escapan de las nanoestructuras y provocan su desintegración. Además, Las nanoestructuras de ADN están bajo el ataque constante de las enzimas nucleasas de ADN que se producen naturalmente en el cuerpo y degradan las moléculas de ADN libres. reduciendo drásticamente su estabilidad, que comúnmente se mide como su vida media. De ello se deduce lógicamente que, al alterar la integridad estructural de las nanoestructuras de ADN, estas fuerzas internas y externas también restringen la liberación de fármacos o la disponibilidad de moléculas informadoras de diagnóstico.
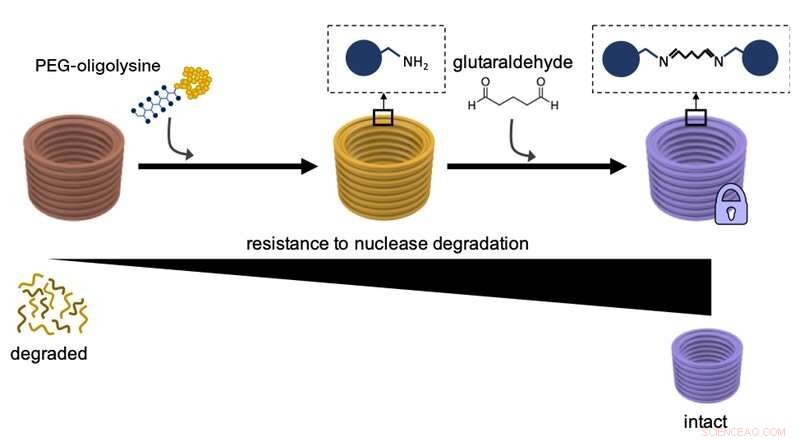
Este diagrama explica cómo el primer recubrimiento de nanoestructuras de ADN con PEG-oligolisinas, y luego reticular químicamente distintas PEG-oligolisinas con glutaraldehído como agente reticulante aumenta su resistencia a la degradación por enzimas de ADN nucleasa y la estabilidad general. Crédito:Instituto Wyss de la Universidad de Harvard
En un estudio anterior, Shih y su equipo encontraron una manera de superar la necesidad de un exceso de Mg 2 + concentraciones para estabilizar nanoestructuras de ADN. Al recubrir esencialmente las superficies de las grandes cadenas de ADN con un agente neutralizante discreto comparativamente pequeño que lleva múltiples cargas positivas y se conoce como PEG-oligolisina (u oligolisina PEGilada), habían inventado un método que se podía aplicar fácilmente para estabilizar nanoestructuras de ADN en todas las formas y formas de forma escalable. La oligolisina pegilada consta de cadenas cortas del aminoácido lisina cargado positivamente, uno de los componentes básicos de las proteínas, que están firmemente unidas al polietilenglicol (PEG). una molécula polimérica capaz de unirse a múltiples cadenas de oligolisina. Los investigadores creen que el PEG funciona como un "cepillo molecular" para evitar la agregación de las nanopartículas neutralizadas.
En contraste con el Mg individual 2 + iones que, En teoria, cada uno puede neutralizar solo dos de las muchas cargas negativas expuestas por la columna vertebral del ADN con sus dos cargas positivas, La oligolisina pegilada puede cubrir múltiples cargas de ADN negativas a la vez, y así forma una "red electrostática" estable que cubre la superficie de las nanoestructuras de ADN. La estabilidad de las nanoestructuras recubiertas incluso se mantuvo en células vivas y ratones. demostrando que el equipo estaba en el camino correcto.
"Con esta sencilla estrategia, podríamos extender la supervivencia de las nanoestructuras de ADN en aproximadamente 400 veces con vidas medias de hasta 36 horas en entornos fisiológicos que también contenían niveles normales de nucleasa, "dijo la primera autora Frances Anastassacos, Doctor., quien en el momento del estudio era un estudiante graduado que trabajaba con Shih. "Sin embargo, esto todavía está por debajo de lo que se necesita en algunas aplicaciones terapéuticas reales. La oligolisina pegilada todavía tendía a desprenderse del ADN hasta cierto punto ".
En el JACS estudio, el equipo resolvió ahora esta parte restante del "problema de estabilidad". "Básicamente, atamos nudos adicionales en la red electrostática utilizando un reactivo de reticulación químico conocido como 'glutaraldehído' que une fuertemente distintas oligolisinas pegiladas en la superficie de nanoestructuras de ADN, ", dijo Anastassacos." En presencia de niveles de ADN nucleasa que superan con creces los del cuerpo humano, su supervivencia se extendió más allá de las 300 horas. El aumento de 400 veces en la estabilidad que observamos con oligolisina pegilada sola se elevó en otras 250 veces, que da en el blanco para aplicaciones clínicas ".
Otros intentos que lograron estabilizar nanoestructuras de ADN con modificaciones químicas se basaron principalmente en el rediseño de estructuras existentes para que sitios específicos dentro de sus estructuras tridimensionales fueran accesibles a la química implementada. A diferencia de, "nuestro enfoque se puede realizar en cualquier nanoestructura de ADN, y su facilidad y rentabilidad podrían fortalecer significativamente la traducción de muchas estructuras terapéuticas y de diagnóstico ya existentes y recientemente diseñadas, "dijo Zhao Zhao, Doctor., quien es co-primer autor del estudio y ex becario postdoctoral en el equipo de Shih.
En su estudio, Shih y su equipo tenían como objetivo maximizar la estabilidad de las nanoestructuras de ADN. Los investigadores, sin embargo, Piense que al variar aún más el paso de reticulación, la vida media de las estructuras podría ajustarse a aplicaciones específicas que requieren que las moléculas de carga estén disponibles en diferentes momentos y en diferentes intervalos de tiempo. Ya descubrieron que su método de protección no interfirió con la unión de las moléculas de carga a las estructuras modificadas y la absorción de las estructuras por las células humanas cultivadas. Ahora, puede comenzar la traducción clínica.