Combinando campos magnéticos de baja potencia, que agita los nanocables, con calentamiento por láser y administración de fármacos, las células diana se pueden matar de manera eficiente. Crédito:KAUST
Los nanocables de hierro recubiertos con fármacos que pueden guiarse al sitio de un tumor mediante un campo magnético externo antes de activar un mecanismo de eliminación del cáncer de tres pasos podrían proporcionar una opción eficaz para la terapia del cáncer.
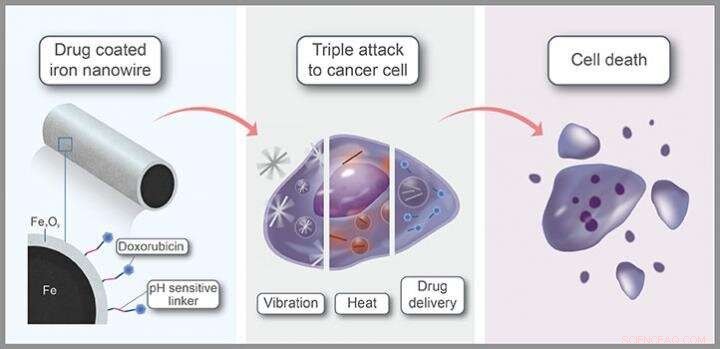
Co-desarrollado por investigadores de KAUST, estos nanocables liberan su carga de fármaco dentro de las células cancerosas, al mismo tiempo que perfora agujeros en la membrana de la célula y entrega una ráfaga de calor. Si bien la terapia de combinación maximiza la muerte de las células cancerosas, su naturaleza altamente específica debería minimizar los efectos secundarios.
El hierro era el material obvio para hacer los nanocables, dice Jürgen Kosel, quien lidera el grupo en KAUST, que incluye a Jasmeen Merzaban y Boon Ooi, y que codirigió el trabajo con investigadores del CIC biomaGUNE en San Sebastián, España.
La primera consideración es la seguridad. "Planchar, en forma molecular, es un material nativo en nuestros cuerpos, esencial para el transporte de oxígeno, "Kosel explica. Los nanocables comprenden un núcleo de hierro, recubierto con una cáscara de óxido de hierro. "Los organismos reguladores han aprobado nanomateriales a base de óxido de hierro para su uso en imágenes por resonancia magnética y como suplemento dietético en casos de deficiencia nutricional, " él dice.
Además de su biocompatibilidad, las propiedades magnéticas de los materiales a base de hierro son un beneficio clave. "Utilizando campos magnéticos inofensivos, podemos transportarlos; concentrarlos en el área deseada; rotar o hacer vibrar, como hicimos en este estudio; e incluso detectarlos a través de imágenes de resonancia magnética, "dice Aldo Martínez-Banderas, miembro del equipo de Kosel. Aplicar campos magnéticos de baja potencia, el equipo agitó los nanocables de una manera que abrió la membrana de las células objetivo, inducir la muerte celular.
La ventaja adicional es que los nanocables núcleo-capa absorben fuertemente la luz infrarroja cercana, calentando mientras lo hacen. Debido a que la luz en esta longitud de onda puede penetrar mucho en el cuerpo, los nanocables podrían calentarse utilizando láseres dirigidos al sitio del tumor. "Los nanocables núcleo-capa mostraron una eficiencia de conversión fototérmica extremadamente alta de más del 80 por ciento, que se tradujo en una gran dosis de calor intracelular, "Dice Martínez-Banderas.
Finalmente, el fármaco anticanceroso doxorrubicina se unió a los nanocables mediante conectores sensibles al pH. Como el entorno del tumor suele ser más ácido que el tejido sano, el enlazador se degrada selectivamente en o cerca de las células tumorales, liberando el fármaco donde se necesita. "La combinación de tratamiento dio como resultado una ablación de células cancerosas casi completa y fue más eficaz que los tratamientos individuales o el medicamento contra el cáncer solo, "Dice Martínez-Banderas.
"Tomados en conjunto, las capacidades de los nanomateriales a base de hierro los hacen muy prometedores para la creación de nanorobots biomédicos, que podría revolucionar la asistencia sanitaria, ", Añade Kosel." Si bien esto puede parecer futurista, los desarrollos van por buen camino ".