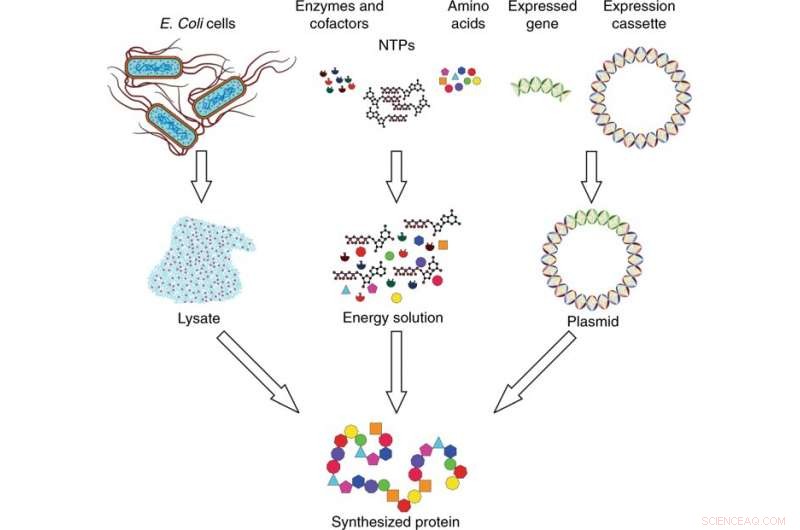
Descripción general del sistema de síntesis de proteínas libres de células. El sistema de síntesis consta de tres componentes:lisado, solución energética, y ADN plasmídico. El lisado se recoge de las células de E. coli mediante lisis celular y se prepara mediante ultracentrifugación. La solución energética está compuesta por nucleósidos trifosfatos (NTP), aminoácidos, enzimas y cofactores. El ADN plasmídico se elabora insertando el gen de interés expresado en un casete de expresión. Los tres componentes se combinan e incuban para sintetizar la proteína de interés. Crédito:Microsistemas y Nanoingeniería, doi:10.1038 / s41378-019-0051-8
Las proteínas terapéuticas son candidatos a fármacos a base de proteínas que se han diseñado mediante bioingeniería en el laboratorio para aplicaciones farmacéuticas y clínicas. Según su farmacocinética, los candidatos se pueden dividir en grupos que (1) reemplazan una proteína defectuosa o anormal, (2) aumentar un camino existente in vivo, (3) proporcionar una nueva función o actividad in vivo, (4) interferir con las actividades de una molécula u organismo y (5) entregar proteínas o compuestos encapsulados que incluyen, fármacos citotóxicos, radionúclidos o proteínas efectoras.
En un estudio reciente publicado en Microsistemas y nanoingeniería , Travis W. Murphy y sus compañeros de trabajo en los Departamentos de Ingeniería de Sistemas Químicos y Biológicos de Virginia Tech desarrollaron un método rentable plataforma sintética y de purificación en el punto de atención para la ingeniería de proteínas. Construyeron un dispositivo integrado de microfluidos "Therapeutics-on-a-Chip (TOC)" para síntesis de proteínas terapéuticas y purificación de proteínas terapéuticas en una sola configuración.
La capacidad de sintetizar proteínas terapéuticas en un lugar de atención, puede reducir rápidamente los costos de almacenamiento y transporte durante la distribución global en regiones con escasos recursos y contribuir al concepto de ciencia frugal. La mayoría de las proteínas se producen actualmente utilizando sistemas de cultivo celular como la Escherichia coli recombinante, levadura, células de mamíferos y células vegetales para la fabricación a gran escala, después de lo cual se distribuyen globalmente desde fundiciones centralizadas. Sin embargo, la vida media limitada de estas proteínas sintéticas requiere instalaciones de almacenamiento y envío a baja temperatura que son un desafío para los pacientes que viven en regiones remotas y de bajos recursos.
En el presente trabajo, Murphy y col. demostró por primera vez los principios de funcionamiento del dispositivo expresando y purificando una proteína informadora:la proteína verde fluorescente. Seguido por el uso de TOC para producir cecropina B, un péptido antimicrobiano ampliamente utilizado para controlar enfermedades de biopelículas. Los científicos sintetizaron y purificaron con éxito cecropina B para producir una concentración de 63 ng / µL en seis horas. con una pureza del 92 por ciento, seguido de la confirmación de sus propiedades antimicrobianas con un ensayo de inhibición del crecimiento. La tecnología TOC proporciona una nueva plataforma para la síntesis y purificación de proteínas en el punto de atención para terapias clínicas accesibles.
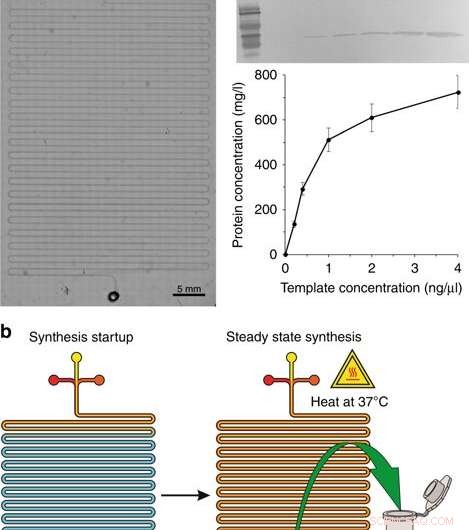
a) Una imagen microscópica del módulo de síntesis. b) Los pasos para la síntesis:inicio de la síntesis y síntesis en estado estacionario. c Western blot de GFP producida en el sistema CFPS y el rendimiento de proteínas con diferentes concentraciones del molde del plásmido. Se usaron anticuerpo primario monoclonal de ratón 6 x His tag y anticuerpo secundario de cabra anti-IgG (H + L) de ratón conjugado con HRP para detectar la proteína diana. Las concentraciones enumeradas son las concentraciones en el volumen de reacción final. Crédito:Microsistemas y Nanoingeniería, doi:10.1038 / s41378-019-0051-8
Los dispositivos de última generación que se utilizan actualmente para la síntesis de proteínas en el punto de uso incluyen un sistema del tamaño de un refrigerador que abarca un ciclo de producción-purificación de dos días para fabricar 800 dosis de un fármaco por día. Sin embargo, el costo de capital asociado con tal sistema no es factible en el mundo en desarrollo, donde la necesidad de una producción rápida de terapias masivas para distribución supera la producción de terapias masivas para almacenamiento a largo plazo. En el sistema TOC desarrollado por Murphy et al. Los científicos lograron la síntesis y purificación de proteínas terapéuticas en el punto de atención mediante un proceso de síntesis de proteínas libres de células (CFPS). En este sistema, las proteínas recombinantes se expresaron sin el uso de células vivas, adecuado para la producción en el punto de atención, donde los materiales de partida liofilizados podrían permanecer estables durante el almacenamiento en un amplio rango de temperatura.
Entre las proteínas examinadas en el estudio, la cecropina B tiene una concentración inhibitoria mínima de 9,5 ng / µL para ejercer efectos antimicrobianos. Usando la configuración de microfluidos, los científicos combinaron la síntesis y la purificación de proteínas para producir un péptido antimicrobiano cecropina B en una dosis clínicamente relevante (63 ng / µL). La producción de flujo continuo en la configuración se completó en tres fases de desarrollo:
Murphy y col. utilizó moldeo de polidimetilsiloxano (PMDS) basado en litografía blanda para fabricar los dispositivos; construcción de multicapas mediante válvulas micromecánicas.
Durante la primera etapa de diseño del dispositivo en el reactor CFPS, los científicos fabricaron un chip microfluídico de canal serpentino, similar a estudios previos para la síntesis de proteínas en chip. El dispositivo de microfluidos contenía entradas conectadas a una bomba de jeringa colocada en la platina de calentamiento de un microscopio, donde tres entradas recibieron (1) lisado celular, (2) Tampón de reacción CFPS y una plantilla de ADN (3) en el canal serpentino largo (aproximadamente 130 cm) con una salida. Los científicos alimentaron los tres componentes de reacción a un caudal combinado de 0,15 µl / min impulsado por una bomba de jeringa durante un tiempo de residencia de 1,5 horas. Calentaron el reactor con un calentador de etapa (37 grados C) y modelaron la configuración utilizando el software COMSOL Multifísica para verificar la mecánica del dispositivo. para una mezcla y reacción óptimas basadas en difusión en el chip. Para validar los principios operativos del dispositivo, Murphy y col. sintetizó la proteína reportera, GFP usando una variedad de plantillas de ADN. El sistema produjo volúmenes de proteína en un tiempo de reacción constante.
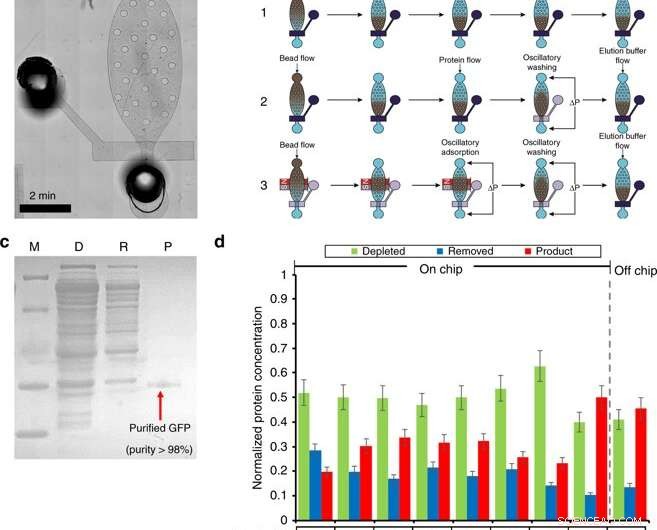
Purificación de proteínas en cámara de microfluidos. a) Una imagen microscópica del módulo de purificación. b) Descripción general del procedimiento de purificación (incluida la carga de perlas, formación del lecho, adsorción de proteínas, Lavado, y elución) mediante tres flujos de trabajo diferentes. El flujo de trabajo 1 utiliza pasos de lavado y adsorción de flujo. El flujo de trabajo 2 utiliza adsorción de flujo y lavado oscilatorio. El flujo de trabajo 3 utiliza adsorción y lavado oscilatorios. El azul oscuro denota una válvula cerrada, donde la transparencia denota una válvula abierta. c) SDS-PAGE de GFP purificada por el chip de purificación. M (marcador); D (Agotado):mezcla de reacción CFPS después de la absorción de perlas; R (eliminado):contaminantes eliminados en el tampón de purificación; P (Producto):GFP purificada en el tampón de elución. d) La optimización de la etapa de purificación. La optimización se llevó a cabo examinando 4 condiciones. (1) Volumen de perlas de Ni-NTA de 5 u 8 µl; (2) Tween-20 al 0,5% añadido a tampones de purificación y elución. (3) Diferentes flujos de trabajo. (4) Diferentes tiempos de adsorción oscilatoria. Crédito:Microsistemas y Nanoingeniería, doi:10.1038 / s41378-019-0051-8
En la segunda fase, Murphy y col. diseñó un dispositivo de microfluidos para la purificación de proteínas basado en un protocolo de lavado y adsorción de alta eficiencia, como lo demostró el mismo equipo de investigación anteriormente. Operaron el dispositivo usando válvulas solenoides para controlar la válvula micromecánica única y los pulsos de presión oscilatorios asociados para realizar la purificación de proteínas en cuatro pasos principales.
En el flujo de trabajo los pasos fueron (1) carga de perlas, (2) adsorción de proteínas, (3) lavado y (4) elución. Para optimizar el proceso, los científicos compartimentaron el método en tres flujos de trabajo diferentes. Murphy y col. luego varió las condiciones que afectan los resultados de la purificación de proteínas para lograr una pureza del producto tan alta como 98.5 por ciento, con un rendimiento del 54,6 por ciento del producto, superando a otros métodos.
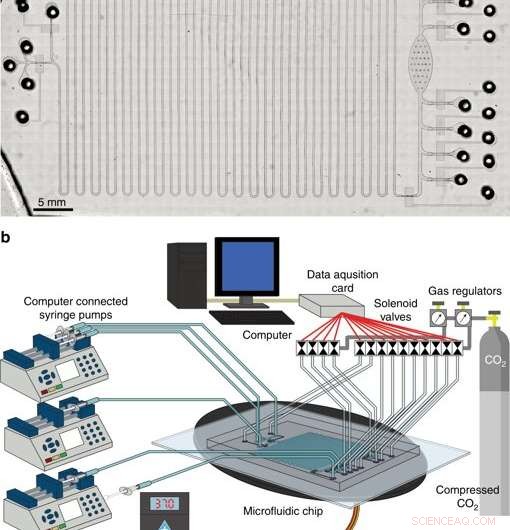
El sistema integrado para la síntesis y purificación de proteínas sin células. a Micrografía de la plataforma CFPS + P integrada. b Descripción general de la configuración de la plataforma CFPS + P integrada. El sistema consta de válvulas solenoides controladas por computadora y bombas de jeringa conectadas a un dispositivo de microfluidos colocado en una etapa de calentamiento. Crédito:Microsistemas y Nanoingeniería, doi:10.1038 / s41378-019-0051-8.
En la fase tres, los científicos desarrollaron una plataforma de microfluidos integrada con síntesis y purificación de proteínas sin células (CFPS + P) para la automatización. Combinaron un reactor de flujo continuo y un dispositivo de purificación por lotes, aunque los dos procesos no eran intrínsecamente compatibles entre sí para empezar. Para lograr una compatibilidad adecuada, interconectaron los dos procesos utilizando un depósito de tubo que almacenaba la proteína producida continuamente en un chip, antes de la purificación. Todos los aparatos utilizados en el estudio para operar el sistema de microfluidos podrían tener el tamaño de un maletín, haciéndolo muy portátil, sistema de producción de proteínas terapéuticas.
En total, el chip CFPS + P totalmente integrado contenía cinco pasos principales, incluidos, cebado, síntesis de proteínas, adsorción de proteínas, lavado y elución. En un sexto paso, los científicos arreglaron perlas refrescantes. Murphy y col. utilizó el canal de síntesis serpentina como módulo de síntesis individual, después de sintetizar la cantidad deseada de proteína, cierran la configuración del módulo de purificación para iniciar el proceso posterior de purificación. Para probar el flujo de trabajo de la configuración, los científicos usaron GFP y lograron una pureza del 98 por ciento.
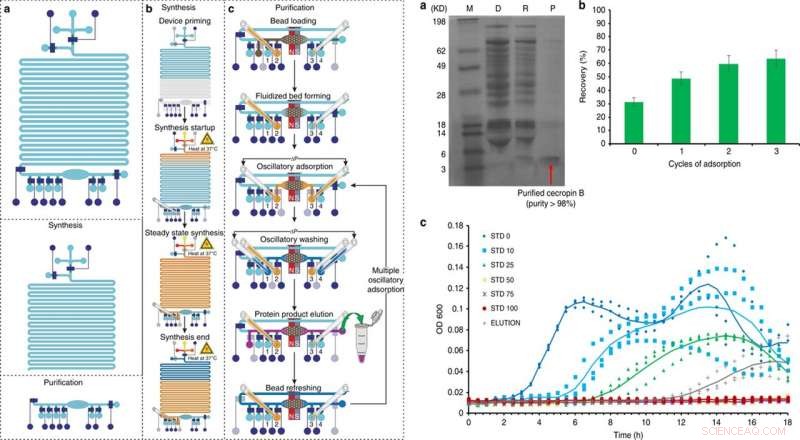
IZQUIERDA:Descripción general y funcionamiento de la plataforma integrada de síntesis y purificación de proteínas libres de células en 5 pasos principales:a) cebado, b) síntesis de proteínas, c) adsorción de proteínas, Lavado, y elución, con un sexto paso opcional de refresco de cuentas. Crédito:Microsistemas y Nanoingeniería, doi:10.1038 / s41378-019-0051-8. DERECHA:Síntesis y purificación de cecropina B mediante dispositivo microfluídico CFPS + P integrado. a) Tricina-PAGE de la cecropina B sintetizada y purificada por el chip integrado. M (marcador); D (agotado):mezcla de reacción de CFPS después de la absorción de perlas; R (eliminado):contaminantes eliminados en el tampón de purificación; P (producto):AMP purificado en el tampón de elución. b) Optimización de la recuperación de cecropina B mediante múltiples ciclos de adsorción. c) Ensayos de inhibición del crecimiento de E. coli realizados por triplicado, utilizando el producto proteico (elución) después de tres ciclos de adsorción / elución con nuestro dispositivo en comparación con estándares de cecropina B de diferentes concentraciones (0-100 ng / μl, denotado como STD 0-100). Se midió la DO600 cada 30 min durante 18 h. Se utilizó la elución con una concentración de 27 ng / μl en 60 μl de solución. Se agregan líneas de tendencia que representan el promedio de tres ensayos para guiar el ojo. Crédito:Microsistemas y Nanoingeniería, doi:10.1038 / s41378-019-0051-8.
Después de la optimización del flujo de trabajo de CFPS + P con GFP, los científicos utilizaron la misma configuración para optimizar las condiciones para sintetizar cecropina B. Siguiendo los pasos de expresión, purificación, electroforesis y tinción en la configuración, Murphy y col. confirmó la producción y purificación con éxito de cecropina B y recuperó proteínas solubles para eluir 63 ng / µL, con una pureza del 92 por ciento. Luego probaron la bioactividad de la cecropina B en relación con E. coli inhibición para demostrar una actividad antibiótica satisfactoria mediante la inhibición del crecimiento bacteriano.
De este modo, Las proteínas terapéuticas sintetizadas y purificadas utilizando la configuración de microfluidos demostraron una supresión activa y eficaz del crecimiento bacteriano. El sistema rentable puede integrarse activamente en entornos de bajos recursos para la ciencia frugal. Murphy y col. tiene la intención de automatizar completamente el sistema en función de las optimizaciones en curso en el futuro. Ellos prevén aplicaciones de la configuración para diseñar una gama de proteínas terapéuticas diversas para una producción rentable en el punto de atención.
© 2019 Science X Network