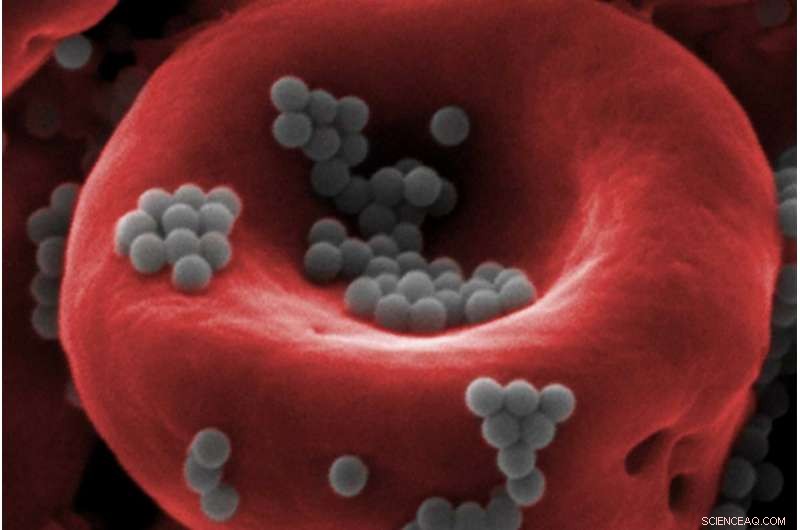
Las nanopartículas (grises) unidas a un glóbulo rojo pueden escapar a la detección del hígado y el bazo del cuerpo. allanando el camino para una mayor eficacia, administración de fármacos menos tóxicos. Crédito:Instituto Wyss de la Universidad de Harvard
Todos los años, se dice a más de 18 millones de personas en todo el mundo, "Tienes cáncer". En los EE.UU., casi la mitad de todos los hombres y más de un tercio de las mujeres desarrollarán algún tipo de cáncer durante su vida, y 600, Más de 000 mueren a causa de ella anualmente. A pesar de los miles de millones de dólares y los innumerables tratamientos nuevos que se le han lanzado desde que el presidente Richard M. Nixon declaró la "guerra" a la enfermedad en 1971, el cáncer se niega a ser golpeado.
¿Por qué sigue siendo un enemigo tan formidable? Después de todo, se sabe desde los días de Nixon que el daño genético no reparado puede hacer que las células crezcan de manera incontrolable, que se considera la causa principal del cáncer. Pero esta comprensión no ha señalado el camino hacia un tratamiento obvio. La investigación sobre la biología del cáncer ha revelado que es una de las enfermedades humanas más complejas e insidiosas por diversas razones.
Primero, el cáncer puede ser causado por varios factores, desde infecciones virales hasta exposición a sustancias químicas cancerígenas y simplemente mala suerte genética. El cáncer de pulmón de un paciente puede ser causado por una constelación de mutaciones completamente diferente a la de otro, y un fármaco que se dirige a un determinado perfil mutacional beneficia solo a un subconjunto de pacientes. Es más, las células cancerosas a menudo desarrollan espontáneamente nuevas mutaciones, limitar la eficacia de los fármacos dirigidos genéticamente.
Segundo, el cáncer es causado por el mal funcionamiento de las propias células del cuerpo, por lo que es difícil diseñar medicamentos que se dirijan solo a las células cancerosas y que no afecten a las sanas.
Tercera, mientras que las mutaciones genéticas pueden impulsar la formación de cáncer, los cánceres pueden dejar de crecer y permanecer inactivos durante años, lo que sugiere que hay más factores en juego que la mutación genética por sí sola.
Y finalmente, el cáncer tiene una serie de "trucos" diferentes que le permiten esconderse del sistema inmunológico altamente vigilante del cuerpo, dejándolo crecer sin ser detectado y sin control hasta que, a menudo, es muy tarde.
Los regímenes de tratamiento del cáncer durante los siglos XIX y XX se limitaron en gran medida a un triunvirato agresivo de la cirugía, radiación, y quimioterapia, todos los cuales conllevan efectos secundarios traumáticos y pueden llevar a los pacientes al borde de la muerte en nombre de salvar sus vidas. A medida que nuestro conocimiento de la enfermedad se ha vuelto más matizado a lo largo de las décadas, se ha producido un cambio de paradigma en el campo, centrado en el reconocimiento de que atacar una enfermedad compleja con herramientas contundentes no es el enfoque más eficaz. Una oleada de nuevas estrategias terapéuticas, incluida la inmunoterapia, nanotecnología, y medicina personalizada:les da esperanza a los pacientes en los que los tratamientos tradicionales han fallado y les ofrece el potencial de curas duraderas.
Científicos del Instituto Wyss de Ingeniería de Inspiración Biológica con experiencia en campos que van desde la biología celular molecular y la inmunología hasta la ciencia de los materiales. Ingeniería Química, mecanobiología, y el origami de ADN están a la vanguardia de varios de estos enfoques novedosos. Su investigación, unidos por el principio común de emular la naturaleza, tiene el potencial de mejorar los tratamientos existentes, crear nuevos, e incluso evitar que el cáncer comience en primer lugar.
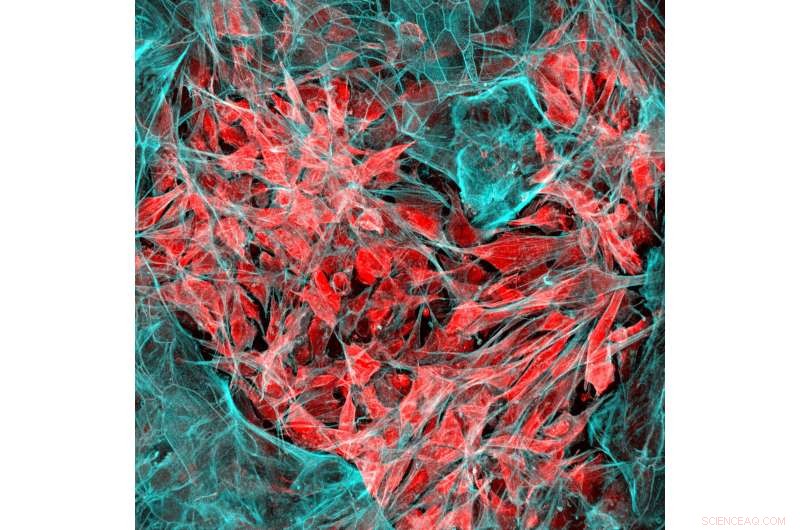
Células de cáncer de pulmón (rojo) que invaden el tejido pulmonar humano (azul). Crédito:Instituto Wyss de la Universidad de Harvard
Una mejor administración de medicamentos está en nuestra sangre
La quimioterapia ha sido la columna vertebral del tratamiento del cáncer durante el último medio siglo, porque infunde medicamentos en el torrente sanguíneo para destruir las células cancerosas que se dividen rápidamente en todo el cuerpo. Sin embargo, Dado que la quimioterapia se dirige sistémicamente a todas las células de crecimiento rápido, también puede dañar los intestinos, médula ósea, piel, cabello, y otras partes del cuerpo, y en algunos casos debe administrarse a una dosis tan alta que casi mata al paciente durante el tratamiento. Los esfuerzos para hacer que los medicamentos de quimioterapia sean menos tóxicos han incluido encapsularlos en nanopartículas que los liberan solo cuando llegan a su ubicación prevista. pero menos del 1 por ciento de los medicamentos encapsulados en nanopartículas alcanzan sus objetivos, como el hígado y el bazo humanos los filtran agresivamente de la sangre.
Samir Mitragotri, un miembro principal de la facultad en el Instituto Wyss, decidió aplicar la ingeniería química al problema de mantener los medicamentos en el torrente sanguíneo el tiempo suficiente para hacer su trabajo. Lo primero que enfrentó fue que los glóbulos rojos y blancos circulan por la sangre varias veces al día, aparentemente escapando a la detección y destrucción por parte del hígado y el bazo.
"Pensé, 'Si estas células no se eliminan naturalmente del torrente sanguíneo, tal vez podamos usarlos para ayudar a que las nanopartículas también permanezcan allí, en lugar de crear un disfraz nuevo y costoso para proteger las nanopartículas, '"dijo Mitragotri, el profesor Hiller de bioingeniería y el profesor Hansjörg Wyss de ingeniería de inspiración biológica en la Escuela de Ingeniería y Ciencias Aplicadas John A. Paulson de Harvard.
El laboratorio de Mitragotri descubrió que el hígado y el bazo de los ratones ignoran las nanopartículas adheridas a los glóbulos rojos. y las nanopartículas se cortan y se depositan en los tejidos cuando las células sanguíneas hacen un apretón particularmente estrecho a través de los diminutos capilares que llevan la sangre a los órganos. Al inyectar nanopartículas unidas a células sanguíneas en un vaso sanguíneo directamente corriente arriba de pulmones humanos completos, los investigadores lograron que el 41 por ciento de ellos se acumulara en el tejido pulmonar, muy por encima del 1 por ciento habitual.
"Simplemente cambiando en qué vaso sanguíneo inyectamos las nanopartículas, podemos administrar una dosis mucho más alta de un medicamento a su órgano previsto, y confíe en el mecanismo de limpieza natural del cuerpo para deshacerse de cualquier partícula que no llegue al objetivo. Incluso podemos conseguir que algunas nanopartículas apunten al cerebro, "Dijo Mitragotri.
A pesar de su mala fama, Es poco probable que la quimioterapia vaya a algún lado pronto, ya que la investigación ha encontrado que las nuevas terapias funcionan mejor cuando se administran en combinación con quimioterapia. Pero tecnologías como las nanopartículas unidas a células sanguíneas podrían ayudar a reducir la dosis que debe administrarse y aumentar la eficacia de la quimioterapia. mejorar la calidad de vida de los pacientes con cáncer en todo el mundo.
Mitragotri también ha tenido éxito al aplicar esta estrategia de "mochila" de nanopartículas a los glóbulos blancos llamados monocitos, que se diferencian en células inmunes llamadas macrófagos que combaten enfermedades, incluido el cáncer. Los monocitos no solo son capaces de llevar consigo sus cargas de nanopartículas de fármacos a medida que se infiltran en los tejidos (lo que podría ayudar a administrar fármacos a los tumores que se encuentran en el interior de los órganos), pero las nanopartículas podrían usarse algún día para controlar los propios monocitos.

La vacuna contra el cáncer del Instituto Wyss imita los ganglios linfáticos del cuerpo al presentar antígenos del tumor de un paciente a las células dendríticas. que luego puede iniciar una respuesta inmune contra el cáncer. Crédito:Instituto Wyss de la Universidad de Harvard
"Una de las cosas disimuladas que pueden hacer los tumores es apagar los macrófagos de una manera similar a como apagan otras células inmunes, tal que hasta la mitad de un tumor puede estar formado por macrófagos inactivos, "Mitragotri explicó." Si podemos enviar una señal química a los monocitos a través de una mochila de nanopartículas que los mantiene en el estado 'encendido' después de que se diferencian en macrófagos, podrían ser mucho más efectivos para atacar un tumor en lugar de convertirse en parte de él ".
Creando un espacio seguro para las células inmunes
Al explorar cómo el control de las células inmunitarias podría ayudar a eliminar el cáncer, Mitragotri está metiendo los dedos de los pies en el floreciente movimiento de inmuno-oncología, razón por la cual es mejor modificar el sistema inmunológico de un paciente (que ya está diseñado para cazar y matar células que funcionan mal) para que pueda superar las tácticas evasivas del cáncer que intentar diseñar un fármaco novedoso para cada tipo de cáncer conocido. La FDA ha aprobado varios enfoques de inmunoterapia en los últimos años, incluidos los medicamentos "inhibidores del punto de control" que frenan las células inmunitarias que han sido inactivadas por las células cancerosas, y terapias con células T, que implican la eliminación de las células T de un paciente, diseñarlos para atacar el cáncer, multiplicándolos, e infundirlos de nuevo en el cuerpo.
Una táctica más nueva vacunas contra el cáncer, intenta modificar el sistema inmunológico de un paciente desde adentro para que no solo ataque los tumores existentes, pero también crea una "memoria" inmunológica para destruir futuros crecimientos cancerosos. Sin embargo, La ingeniería de ese proceso para que tenga lugar completamente dentro del cuerpo ha demostrado ser un desafío. La única vacuna contra el cáncer que la FDA ha aprobado hasta ahora fue Provenge, en 2010. Fue un fracaso comercial debido a sus elevados $ 93, 000 precio y complicado, proceso de tratamiento de varios días que requirió múltiples infusiones.
Pero una persona quedó cautivada más que decepcionada por el fracaso público de Provenge:David Mooney, miembro fundador de la facultad de Wyss y profesor de bioingeniería de la familia Robert P. Pinkas en SEAS. "Mi laboratorio ha tenido un interés desde hace mucho tiempo en las terapias basadas en células para enfermedades como el cáncer. Pensamos que el concepto de entrenar el propio sistema inmunológico del cuerpo para combatir el cáncer era realmente hermoso, pero nos preguntamos si había alguna manera de simplificarlo moviendo todo ese proceso al cuerpo en lugar de hacer partes de él en un laboratorio, como requería Provenge ".
El cuerpo tiene un campo de entrenamiento natural en forma de ganglios linfáticos, que albergan células inmunes llamadas células dendríticas que se activan e inician una respuesta inmunitaria cuando detectan evidencia de un patógeno invasor de los vasos linfáticos. Células cancerígenas, sin embargo, secretan señales inmunosupresoras que pueden interrumpir este proceso. Un científico de materiales e ingeniero químico de formación, Mooney se dio cuenta de que si podía construir e implantar un ganglio linfático artificial hecho de un material que fuera distinto del resto del cuerpo (y por lo tanto protegido de la influencia del cáncer), podría proporcionar un refugio seguro en el que activar las células dendríticas, que luego desencadenaría el ataque del sistema inmunológico contra el cáncer.
Su laboratorio ha hecho precisamente eso, crear una vacuna contra el cáncer en forma de un disco esponjoso del tamaño de una tableta de aspirina que se implanta en un paciente y se biodegrada una vez que ha hecho su trabajo. Esencialmente un ganglio linfático artificial, la vacuna contiene señales que atraen las células dendríticas y las activan con proteínas que se encuentran en las células tumorales del paciente. Las células dendríticas activadas luego viajan al ganglio linfático más cercano, donde entrenan a otros tipos de células inmunes para reconocer y destruir el tumor. This may provide the additional benefit of protecting against recurrences of the cancer—even in another location—since the trained T-cells can proliferate and circulate through the body looking for the same kind of tumor cells to attack and destroy.
Dramatic responses in cancerous mice that received the vaccine spurred Mooney and his collaborators at the Dana-Farber Cancer Institute (DFCI) to start a phase 1 clinical trial with support from both institutes, to see if it had the same effect in human patients. This kind of study is usually undertaken by hospitals and pharmaceutical companies, but rarely inside academia. In traditional pharmaceutical and biotech environments the process of getting such an innovation into clinical trials usually takes six or seven years, in this case the vaccine was tested in its first patient just three years after initial publication of its development. The results attracted the attention of the drug giant Novartis, which licensed the technology from the Wyss Institute in 2018 and took the reins for future clinical trials, with plans to develop the concept into a treatment for multiple kinds of cancer.
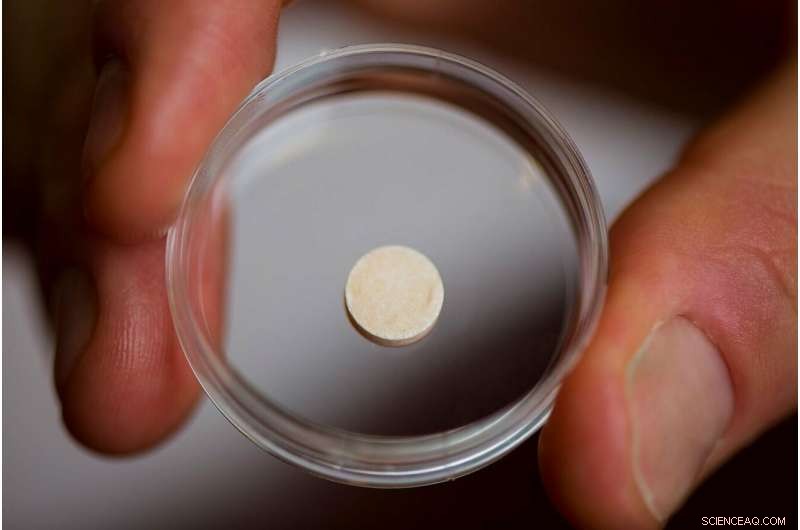
The vaccine is about the size of an aspirin tablet, and is placed inside a patient’s body using a simple incision. It also biodegrades safely, and multiple vaccines can be implanted in the same patient. Credit:Wyss Institute at Harvard University
"The Wyss Institute was just starting, and we knew we wanted to focus on translating discoveries from the lab to the clinic, " said Mooney. "So we saw the cancer vaccine not only as a treatment with real potential to help lots of patients, but also as an opportunity to create a path for moving novel therapies out of academia and into the real world faster. There is no way I could have run a clinical trial out of my laboratory, so being able to build a team inside the Wyss to do the experiments and manufacturing needed for the FDA application, and partnering with DFCI to organize and run the clinical trial, was really what allowed us to get to the point where we're implanting the vaccines in cancer patients so quickly."
One such patient, profiled in a recent Boston Globe article, remains cancer-free nearly two years after being vaccinated for advanced melanoma. But Mooney is not content to rest on his laurels. "Cancer is a complex disease, and it's unlikely there will be a single answer for all people and all kinds of cancer, so we need to keep exploring different approaches, " él dijo.
One of these approaches is a partnership with another Wyss faculty member, William Shih, who has long been interested in how his research on DNA molecules that self-assemble into defined 3-D structures—also known as DNA origami—can improve the precision with which cancer therapy is delivered. Shih and Mooney are working on a joint project to see if DNA origami–based nanostructures can be incorporated into the cancer vaccine to enhance its ability to create a sustained immune response.
"When dendritic cells are activated, either in a lymph node or in the cancer vaccine, they have a decision to make:Do they initiate an antibody response, where antibodies are produced that bind to a specific pathogen and mark [the cancer cells] for destruction, or do they initiate a T-cell response, where they send T cells to destroy the pathogen directly?" explained Shih, a professor of biological chemistry and molecular pharmacology at DFCI and Harvard Medical School (HMS). "We want to nudge them toward the T-cell response, because it's a more effective way to kill cancer cells."
Shih's DNA origami nanostructures take advantage of the fact that DNA is a very stable and predictable compound thanks to the strong bonds between its four chemical bases. By constructing strands of DNA whose sequences of bases along their length are precisely known, Shih and his lab have been able to design 3-D DNA structures that effectively build themselves like automated Lego blocks, and whose properties can be tuned down to the nanoscale.
For the cancer vaccine, Shih's lab has designed a DNA "cask" structure that presents a densely packed, precisely arranged display of ligands, or molecules that bind to other molecules, which are usually found on pathogens like bacteria or viruses and are recognized by the body's immune system as foreign. These ligands essentially produce a danger signal recognized by dendritic cells, and can make them choose to initiate a T-cell immune response more often than an antibody response. "Our initial data suggest that the precise patterning of ligands we're able to achieve with DNA origami make a big difference in activating the dendritic cells the way we want them to be activated, " Shih said. "We have this miracle [vaccine]. Let's make it better."
A Neighborhood Watch for cancer
Immunology is all the rage for treating cancers after they occur, but every cancer arises from what was once a normal cell. What if we could tease out exactly what promotes the development of cancer and find a way to reduce the chances it will form in the first place? That's a tall order, as hundreds of substances are known to cause cancer, hundreds more are suspected but unproven carcinogens, and other factors such as lifestyle and genetics all conspire to damage our DNA.
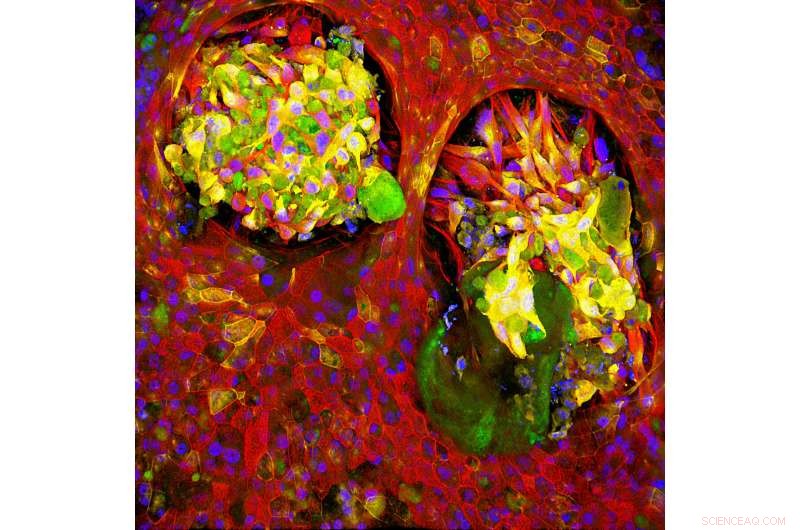
Healthy lung tissue (red) surrounds cells that express markers typically found on both cancerous and healthy cells (green and yellow) in a Lung Cancer Chip, indicating that the relationship between normal and cancerous cells is more complex than originally thought. Credit:Wyss Institute at Harvard University
But some causes play an outsized role in cancer's development, such as chronic inflammation, which is associated with nearly 25 percent of all human cancers. Research being undertaken by the Wyss Institute's founding director, Donald Ingber is now investigating the possibility of treating the inflammation of the connective tissue and blood vessels that surround and support organs (known collectively as the stroma) rather than directly attacking tumors themselves.
"Understanding how stromal tissues can influence the development of cancer has intrigued me personally since the time I was a graduate student, " said Ingber, who is also the Judah Folkman Professor of Vascular Biology at HMS and Boston Children's Hospital and a professor of bioengineering at SEAS. "We and others have shown that changes in the physical structure and composition of the stroma can promote cancer formation and, en cambio, that putting cancerous cells into a healthy stromal environment can suppress tumor growth, suggesting that targeting the tumor microenvironment could lead to new cancer-reversal therapies."
Ingber is part of a global research team tackling this problem from multiple angles as part of Cancer Research UK's Grand Challenge, a competition it won earlier this year. Key to the project is Ingber's organ chip technology, which allows researchers to carry out human organ–level experimentation in vitro. Each organ chip is a microfluidic culture device containing hollow microchannels that can be lined with living human epithelial and stromal cells, which experience physical conditions similar to those found in the body, including blood flow, breathing motions in the lung, peristalsis in the intestine, and so forth. The Wyss Institute has created organ chips that faithfully mimic the lung, riñón, intestine, bone marrow, brain, and more, allowing researchers to grow tumor cells within the natural microenvironments found in the body and then test treatments without exposing animals or patients to potentially harmful conditions.
"Our organ chips have shown us time and time again that in order for organ cells to function normally, they have to be provided with the right microenvironment, " said Ingber. "For this project, we will build models of different stages of cancer progression using cells isolated from human patients to understand how interactions between stromal cells and organ-lining cells change as inflammation-associated cancers form, as well as develop new ways to combat this response."
By combining organ chips with bioinformatics and machine-learning approaches, the team hopes to identify new stromal-targeted treatments that can restore inflamed tissue to its healthy form, thereby preventing cancer progression, or induce cancerous or precancerous tissues to revert to a more normal state. By studying human cancer progression in vitro, the team also hopes to discover new diagnostics that can be used to identify the small subset of patients with inflammation-associated premalignant conditions, such as Barrett's esophagus or ulcerative colitis, that might progress to cancer.
"Treating cancer is ultimately going to need to be a multifaceted approach, because the disease itself is so multifaceted, " Ingber said. "The Wyss Institute was founded on the basis of bringing people together from different disciplines to tackle big problems in medicine through communication and collaboration among experts with a broad range of different perspectives. Doing that within the Wyss Institute has led to advances like organ chips, and doing that at a larger scale, such as with the Grand Challenge, allows whole institutions to put their resources together and drive real change for millions of patients living with devastating diseases like cancer worldwide."
Whether targeting blood cells, the immune system, or stromal tissue, all of these projects are guided by the principle of using existing biological elements as the basis for new therapies, rather than trying to invent new cures from scratch.
"The human body is a marvel of biological engineering that has been tuned over millions of years to be able to fight off threats and heal itself, " said Ingber. "When we can recognize its inherent abilities and work with them rather than against them, we are taking full advantage of all the experimentation that evolution has already done for us. We believe this type of interdisciplinary, bio-inspired approach can help create more new treatments for cancer and other complicated diseases much more effectively than traditional drug development strategies."
This story is published courtesy of the Harvard Gazette, Harvard University's official newspaper. For additional university news, visit Harvard.edu.