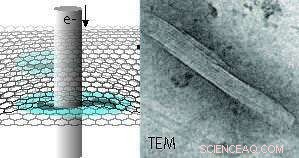
Representación esquemática de proteínas de microtúbulos hidratados encapsuladas entre dos capas de grafeno obtenidas mediante microscopía electrónica de transmisión (TEM). A la derecha se muestra un ejemplo de una imagen TEM de un microtúbulo. El revestimiento interior refleja la estructura del protofilamento del microtúbulo polimérico. Gratis dentro de este comunicado de prensa. Crédito:INM, Niels de Jonge
La microscopía electrónica es uno de los principales métodos utilizados para examinar la estructura de las proteínas. El estudio de estas estructuras es de importancia clave para dilucidar su función alimentando información fundamental en una serie de campos como la biología estructural, Biología Celular, Investigación sobre el cáncer, y otros campos biomédicos. También mejora la comprensión de la biomineralización.
Una nueva opción para obtener imágenes de proteínas es la microscopía electrónica de fase líquida (LPEM), que es capaz de obtener imágenes de la estructura de la proteína nativa (sin teñir) y otras muestras como nanomateriales o células en líquido. Esta tecnología se desarrolló durante los últimos quince años. Hasta hace poco, debatió si la tolerancia a la radiación de las muestras líquidas sería mejor o peor en comparación con el hielo amorfo. En su reciente publicación, Sercan Keskin y Niels de Jonge del INM-Leibniz Institute for New Materials ahora demuestran:que la tolerancia a la radiación aumenta en un orden de magnitud en comparación con una muestra en hielo. Este resultado se logró mediante la preparación de una muestra de microtúbulos en una celda de grafeno líquido. Es esencial utilizar la velocidad más baja posible a la que se aplicó la irradiación con haz de electrones.
Tradicionalmente, las muestras fueron arregladas, teñido con un metal para realzar su contraste, posteriormente secado, incrustado en plástico, cortar en secciones delgadas, y luego fotografiado en el ambiente de vacío requerido para microscopía electrónica. La crio microscopía electrónica supera los inconvenientes asociados con esta preparación de muestra y proporciona los medios para estudiar proteínas en un estado hidratado cercano al nativo preparándolas en hielo amorfo. Sin embargo, una imitación clave es la alta sensibilidad de las muestras a la irradiación con haz de electrones, de modo que el ruido estadístico en la imagen evita la alta resolución y es necesario obtener imágenes de muchas diez mil imágenes ruidosas de estructuras idénticas para resolver la estructura.