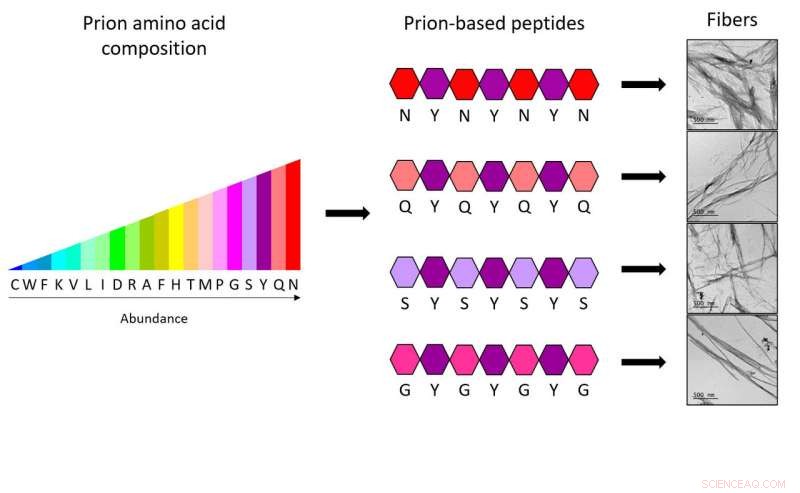
Con los nuevos heptapéptidos, investigadores del IBB-UAB demuestran que solo cuatro tipos diferentes de aminoácidos, distribuidos de forma específica y combinados siempre con otro quinto tipo, son suficientes para obtener el código completo necesario para formar fibras priónicas sintéticas. Crédito:IBB-UAB
Investigadores del Instituto de Biotecnología y Biomedicina (IBB-UAB) han generado cuatro péptidos, moléculas más pequeñas que las proteínas, capaz de autoensamblarse de manera controlada para formar nanomateriales. La investigación, publicado en la revista ACS Nano , fue realizada por Salvador Ventura, Marta Díaz Caballero y Susanna Navarro (IBB-UAB), y contó con la colaboración de Isabel Fuentes y Francesc Teixidor (Instituto de Ciencia de Materiales de Barcelona, ICMAB-CSIC).
Las nuevas moléculas están formadas por una cadena de siete aminoácidos, cada uno de los cuales se compone de solo dos aminoácidos, De esta manera se acelera y se reduce significativamente el costo de creación de estructuras amiloides sintéticas funcionales con las que generar nanomateriales para biomedicina y nanotecnología.
En biotecnología, generar estructuras amiloides sintéticas funcionales para formar nanoestructuras imitando el proceso de generación natural no es nuevo. El ensamblaje de proteínas en fibras estables permite crear formas supramoleculares que ninguna proteína aislada puede crear. y que se utilizan como nanoconductores, estructuras fotovoltaicas, biosensores y catalizadores.
Recientemente, Los investigadores comenzaron a sintetizar secuencias de proteínas priónicas para formar nanomateriales. El interés de estas secuencias radica en que las proteínas se ensamblan de forma más lenta y controlada, formando muy ordenado, nanoestructuras no tóxicas. Sin embargo, el hecho de que la secuencia sea tan larga, con más de 150 aminoácidos, lo hace muy difícil y costoso de sintetizar.
"Hemos demostrado que un diseño adecuado puede permitir que el tamaño de las secuencias de priones sintéticos se reduzca a solo 7 aminoácidos, conservando las mismas propiedades. Los cuatro péptidos que hemos fabricado son las estructuras más cortas de este tipo creadas hasta ahora, y son capaces de formar conjuntos de fibrillas estables, "dice Salvador Ventura, investigador del IBB y del Departamento de Bioquímica y Biología Molecular de la UAB.
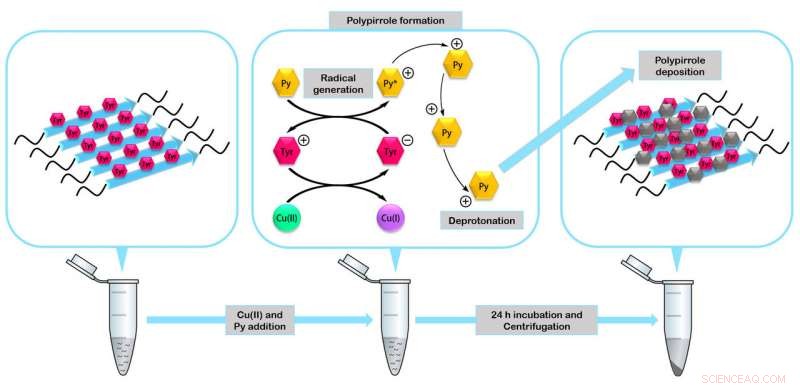
Los péptidos se ensamblan para formar enzimas en miniatura capaces de actuar como catalizadores en la formación de nanomateriales como el polímero conductor polipirrol. Crédito:IBB-UAB
En el estudio, los investigadores verificaron la estabilidad y funcionalidad de los cuatro péptidos fabricados. Construyeron uno de los nanomateriales biológicos más resistentes a la degradación descritos hasta la fecha, nanocables recubiertos de plata que pueden actuar como nanoconductores eléctricos y mini enzimas fibrilares capaces de actuar como catalizadores en la formación de nanomateriales orgánicos.
Las nuevas moléculas tienen numerosas aplicaciones, pero los investigadores pretenden centrarse en "la generación de nanoconductores eléctricos y aprovechar el conocimiento de la estructura amiloide para generar fibras sintéticas capaces de ser catalizadores de nuevas reacciones químicas. El objetivo final será generar materiales híbridos péptido-inorgánicos capaces de haciendo reacciones complejas, como los creados por los fotosistemas de las plantas, ", señala el investigador del IBB.
Dominios de priones, En el corazón de la cuestión
Para generar nuevos péptidos, Los investigadores del IBB basaron su trabajo en secuencias específicas de proteínas priónicas, conocidos como dominios priónicos (PrD). "Estudiamos qué aminoácidos son más frecuentes y cómo se distribuyen en estas regiones, demostrando que solo 4 tipos diferentes de aminoácidos distribuidos de una manera específica y siempre combinados por un quinto tipo de aminoácido son suficientes para tener el código completo necesario para formar fibras priónicas sintéticas. De hecho, cada uno de los heptapéptidos (mini-PrDs) diseñado solo contiene dos tipos diferentes de aminoácidos, "dice Salvador Ventura.
El estudio demuestra la capacidad de ensamblaje de mini-PrD en nanoestructuras altamente ordenadas, un proceso que se cree imposible dada la gran presencia de aminoácidos polares. Los péptidos resultantes son más polares que cualquier otro péptido de tamaño similar utilizado hasta ahora para formar amiloides sintéticos; esta, por ejemplo, les permite funcionar en las mismas condiciones que las enzimas naturales.
Este estudio ha servido para ayudar a los investigadores del grupo IBB Protein Folding and Conformational Diseases, dirigido por el Dr. Ventura, abrir una nueva línea de investigación centrada en el diseño de nanomateriales.
"Nunca hemos trabajado en nanotecnología, pero al mismo tiempo siempre lo hemos tenido cerca, porque nuestra fortaleza radica en el conocimiento del mecanismo molecular del ensamblaje de proteínas en estructuras amiloides. Hace tiempo que trabajamos para crear estrategias con las que evitar este fenómeno en las enfermedades neurodegenerativas. Este conocimiento nos ha permitido diseñar nuevas moléculas que ahora proponemos para la fabricación de nuevos nanomateriales, "Concluye el Dr. Ventura.