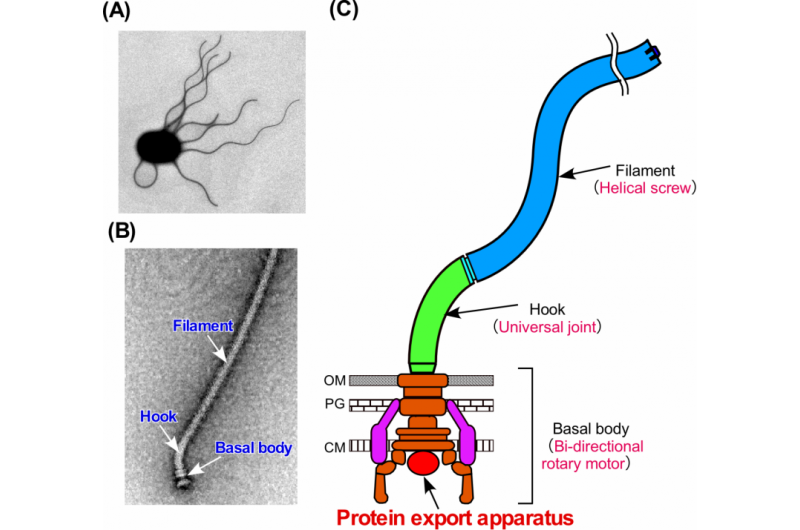
Figura 1. El flagelo bacteriano. (A) Micrografía electrónica de una célula de Salmonella. (B) Micrografía electrónica de Salmonella flagellum. (C) Diagrama esquemático del flagelo. El flagelo consta de al menos tres partes:el cuerpo basal como motor rotatorio bidireccional, el gancho como junta universal y el filamento como tornillo helicoidal. Crédito:Universidad de Osaka
Los investigadores de la Universidad de Osaka utilizan cristalografía de rayos X y microscopía electrónica para resolver el ensamblaje del aparato de la puerta de exportación en Salmonella. Se espera que los nuevos detalles de esta nanomáquina aclaren cómo las bacterias infectan las células eucariotas y presenten nuevos objetivos moleculares para el descubrimiento de fármacos.
Una de las nanomáquinas más antiguas de la biología es el flagelo bacteriano. Este aparato es esencial para la evolución, dotando a las bacterias de la capacidad de moverse. El flagelo comparte una gran similitud con otra estructura bacteriana, el inyectisoma, que, como su nombre lo indica, es cómo algunas bacterias entregan su contenido para infectar a un huésped. Un nuevo estudio realizado por investigadores de la Universidad de Osaka revela cómo una estructura específica en el flagelo y el inyectisoma, el complejo de la puerta de exportación, ensambla dinámicamente y cómo prevenir este ensamblaje podría hacer que las bacterias sean inocuas. El estudio se puede ver en PLOS Biología .
El profesor asociado Tohru Minamino de la Escuela de Graduados de Frontier Biosciences ha estado estudiando el complejo de la puerta de exportación durante muchos años utilizando microscopía electrónica. Su interés en este complejo se centra principalmente en la ingeniería de nuevas nanomáquinas, pero se ha dado cuenta de que la misma investigación podría tener implicaciones médicas.
"Hay muchas similitudes estructurales y funcionales entre las proteínas flagelar y del inyectisoma. Podrían ser buenos objetivos para inhibir la infección bacteriana, " él dijo.

Figura 2. Modelo de la estructura del anillo FliP. FliP forma un homohexámero. El complejo FliO actúa como un andamio para unirse a FliP para facilitar la formación del anillo FliP. Crédito:Universidad de Osaka
El complejo de exportación de Salmonella flagellum consta de cinco proteínas transmembrana. Estos se ensamblarán secuencialmente para formar la puerta de exportación, comenzando con la proteína FliP. Se cree que la puerta de exportación en el inyectisoma de Salmonella se ensambla de manera similar utilizando cinco proteínas homólogas. Minamino muestra que aunque no es parte de la estructura de la puerta, una sexta proteína transmembrana, FliO, es esencial para comenzar el montaje de la puerta.
"FliO actúa como un andamio para que FliP forme una estructura de anillo. Sin este anillo, las otras proteínas transmembrana no seguirán al complejo de la puerta, " él dijo.
Las imágenes de microscopía electrónica indicaron que el andamio FliO hace que FliP forme un hexámero, lo que permite que las proteínas transmembrana posteriores se unan al ensamblaje. Los cálculos electrostáticos identificaron qué aminoácidos específicos en FliP eran críticos para las interacciones FliO-FliP y las interacciones FliP-FliP, proporcionar dianas candidatas para fármacos experimentales. Para demostrar que FliO es necesario para el ensamblaje de la puerta de exportación y no para la estructura, Minamino demostró que la sobreexpresión de FliP puede evitar el defecto de FliO y proceder a completar el aparato de la puerta de exportación.
Aunque FliO permite que FliP forme un hexámero, la proteína homóloga FliP en el inyectisoma, SpaP, forma un pentemero y un heterohexámero junto con SpaR, la proteína homóloga FliR. El análisis computacional sugirió que FliP también podría tomar esta estructura.
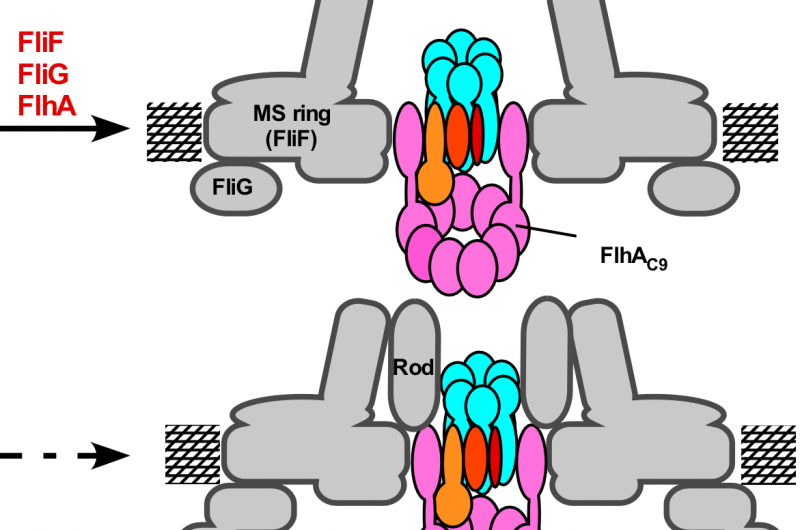
Figura 3. Modelo para el proceso de ensamblaje del aparato de exportación flagelar. El montaje del complejo de la puerta de exportación comienza con la formación del anillo FliP con la ayuda del complejo FliO, seguido del montaje de FliQ, FliR, y FlhB y finalmente de FlhA durante la formación del anillo de MS en la membrana citoplasmática. Una vez completada la estructura del anillo C, el complejo de anillo de ATPasa citoplasmático se forma en la base flagelar, permitiendo que los sustratos de exportación entren en la cavidad central del complejo de anillos FliP. Crédito:Universidad de Osaka
"Un número significativo de las partículas del anillo FliP que analizamos podría asignarse a un análisis rotacional de 5 veces, para que pudieran formar pentámeros. Estamos seguros de que FliP es un buen modelo para SpaP, "dijo Minamino.
Identificación del primer paso para el montaje de la puerta de exportación, a saber, la oligmerización de FliP a través de interacciones FliO, sugiere una forma potencial de alterar la patología de bacterias como Salmonella.
"Nuestros hallazgos sugieren que los homólogos de FliP del inyectisoma son objetivos farmacológicos prometedores, "dijo Minamino.